I – Une réaction chimique produit de l’énergie.
Expérience :
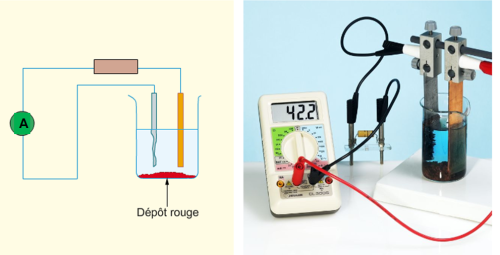
► On introduit une solution de sulfate de cuivre dans un tube à essai et on relève la température.
► Puis, on introduit dans ce tube de la poudre de zinc et on agite.
► On relève à nouveau la température.
Interprétation :
► Des ions Cuivre II Cu2+ ont été consommés.
► Du métal Cuivre Cu s’est formé.
► Des ions Zinc II Zn2+ se sont formés car si on ajoute de la soude à la solution finale, il se forme un précipité blanc.
► La température augmente lors de la réaction, donc de l’énergie thermique est libérée.
Conclusion :
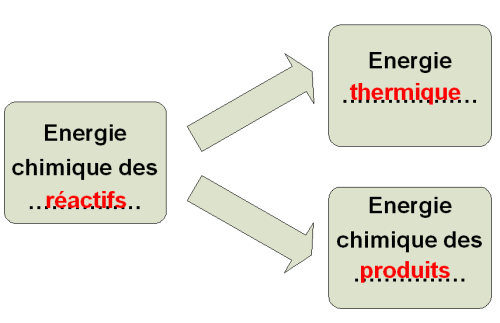
Le sulfate de cuivre réagit avec le zinc : l’ensemble des réactifs possèdent de l’énergie chimique.
Lors de la transformation chimique, une partie de cette énergie est transférée à l’extérieur sous forme d’énergie thermique.
 II – Fabrication et étude de la pile Cuivre/Zinc.
II – Fabrication et étude de la pile Cuivre/Zinc.
Expérience :
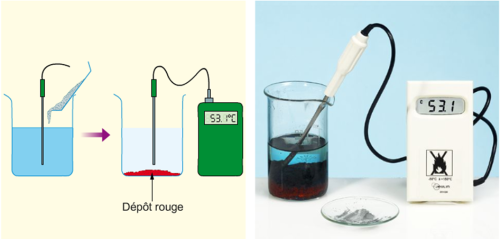
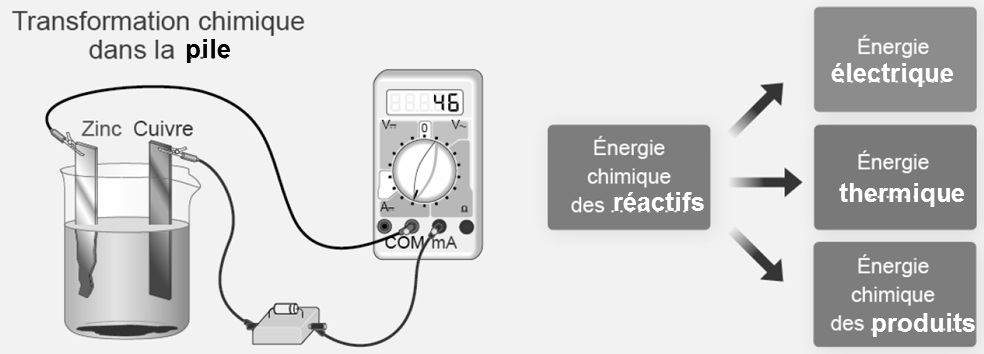
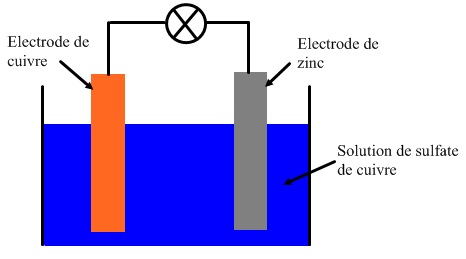
► On plonge deux lames métalliques (électrodes), l’une en cuivre et l’autre en zinc, dans un bécher contenant une solution de sulfate de cuivre.
► On relie les deux électrodes à un voltmètre.
► On mesure ensuite l’intensité du courant débité par la pile après avoir inséré une résistance dans le circuit.
Observation :
Le voltmètre indique une tension d’environ 1V lorsque sa borne V est reliée à l’électrode de cuivre.
► L’ampèremètre indique une intensité d’environ 50 mA.
► L’électrode de zinc est rongée et du métal cuivre se dépose sur l’électrode de cuivre.
► La solution se décolore.
Interprétation :
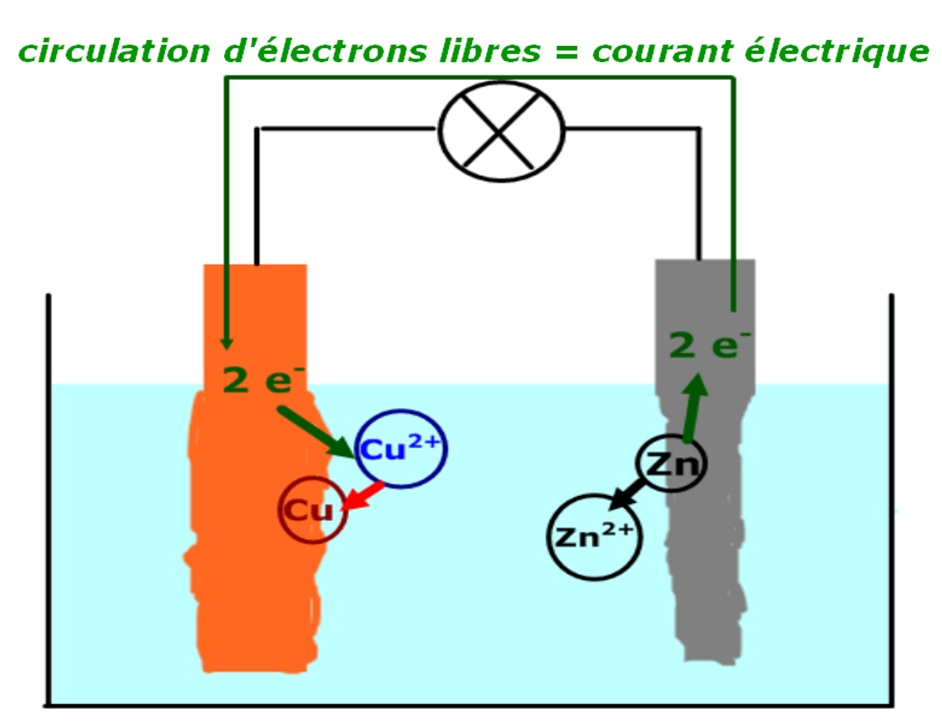
L’électrode de cuivre constitue l’électrode positive de la pile et l’électrode de zinc constitue la borne négative.
La pile s’use :
► Du métal Zinc disparaît et des ions Zn2+ apparaissent.
► Des ions Cu2+ disparaissent et du métal cuivre se dépose sur l’électrode de cuivre.
Conclusion :
Une pile électrochimique est constituée de deux électrodes de natures différentes, généralement métalliques, plongeant dans un solution conductrice.
Lorsque la pile fonctionne, il se produit une transformation chimique (celle du paragraphe précédent).
Une partie de l’énergie chimique des réactifs est convertie en énergie électrique et une autre partie est transférée à l’extérieur sous forme d’énergie thermique .
La consommation des réactifs entraîne « l’usure »de la pile.
Pile Cuivre/Zinc
III – Les piles.
1) Historique
En 1800, Volta (physicien italien) invente la première pile électrique.
En effet, il s’aperçut qu’en empilant des disques de cuivre et de zinc en alternance, chaque paire étant séparée de sa voisine par un tissu imbibé d’eau salée, il obtient un courant électrique continu.
Cet empilement d’une soixantaine de disques sera nommé « pile ».
Histoire de la pile : De Galvani à Volta
2) Les piles du commerce.
Les piles du commerce sont de trois types :
► La pile saline (ou pile Leclanché) : c’est la plus ancienne et la moins chère mais sa durée de vie est courte. Elle délivre une tension de 1,5 V.
On l’utilise pour des utilisations peu exigeantes : réveil, jouets…
► La pile alcaline : de constitution très proche de la pile saline ( la grande différence se situe au niveau de l’électrolyte qui dans ce cas est de la potasse – composé alcalin – au lieu du chlorure d’ammonium de la pile saline), elle délivre une tension de 1,5V mais peut fournir des courants plus importants pendant plus longtemps. Elle est plus chère.
Elle convient à des usages plus exigeants : appareils photo, mp3….
► La pile au lithium : Elle est encore plus chère, mais délivre beaucoup plus d’énergie que les précédentes. Sa tension peut varier de 1,2V à 3,5V. Elle permet un usage de longue durée.
On l’utilise dans les calculatrices, montre, stimulateurs cardiaques …


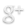









Ping :CHIMIE - Collège & Lycée St Gabriel - Valréas