I – La structure de l’atome.
1) Historique du modèle de l’atome
Dès 420 avant J.C., Démocrite (philosophe grec) a l’intuition de l’existence des atomes et invente leur nom (« atomos » en grec qui signifie insécable). Ceux-ci sont très petits, de différentes formes (rond ou crochus, lisses ou rugueux) et s’associent pour former les objets qui nous entourent.
Aristote (philosophe grec) conteste cette existence et son prestige est tel qu’il faut attendre le début du XIXème siècle pour que cette idée reprenne vie.
Les alchimistes du Moyen Age développent une chimie du « pifomètre ». Elle consiste plutôt en de multiples tentatives d’expériences plus ou moins au hasard en vue d’un but, par exemple transformer le plomb en or ! Si la compréhension des phénomènes inhérents aux expériences ne les intéresse pas leurs comptes rendus se révèlent de bonnes sources d’information pour les premiers chimistes « modernes » tel Lavoisier.
En 1647, un français, Pierre GASSENDI, remet au goût du jour l’idée d’atomes et affirme que toutes les substances se composent de particules indivisibles, les atomes. Les atomes diffèrent par la forme , la grandeur et la masse. Selon lui, l’atome, c’est la même chose que le matériau de construction des maisons. Avec trois sortes de matériaux – briques, planches et poutres – on peut construire une foule de bâtisses des plus diverses. De la même façon, quelques dizaines d’atomes différents permettent à la nature de créer des milliers de corps absolument différents. Dans chacun des corps, ces atomes se réunissent en petits groupes que Gassendi appellera « molécules ».
- En 1805, John Dalton annonce au monde l’existence des atomes.
- En 1881, J.J. Thomson découvre l’un des composants de l’atome. Il s’agit de particules élémentaires négatives appelées en 1891 électrons.
- Au début du XXème siècle, l’ambition des physiciens est de proposer un modèle de l’atome en précisant la répartition de la charge électrique à l’intérieur de celui-ci.
- En 1904, Thomson partant de l’idée que l’atome est électriquement neutre, pense qu’il doit contenir des charges positives qui doivent compenser les charges négatives des électrons. Il suppose que la charge positive est répartie dans un petit volume (qui peut avoir la forme d’une sphère) et qu’elle est parsemée d’électrons (pudding de Thomson).
- En 1910, Rutherford bombarde différents échantillons de matière (cuivre, or, argent) avec des particules et il déduit de son expérience que la charge positive doit occuper un tout petit volume qu’il appelle « noyau ». Après « un petit calcul », il trouve que la majorité de la masse de l’atome est concentrée dans un noyau minuscule. Les dimensions du noyau sont de l’ordre de 10-15 m (100.000 fois moins que les dimensions de l’atome) et sa charge totale est un multiple entier de la charge de l’électron (au signe près).
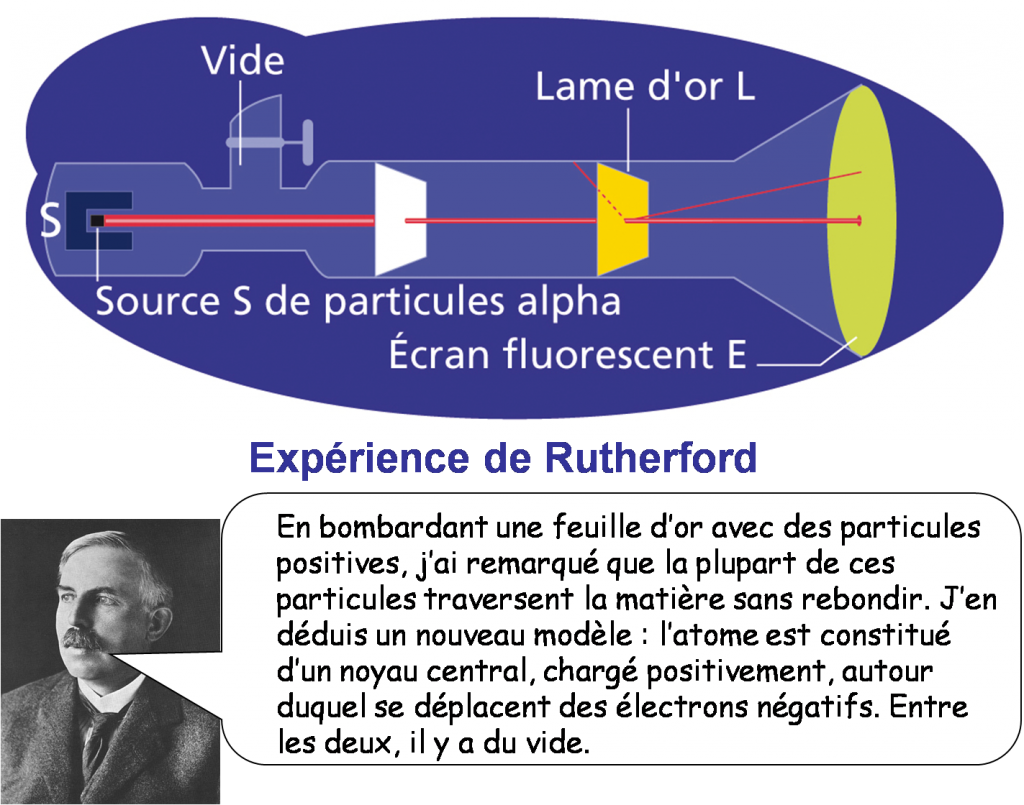
- Rutherford pense alors au modèle planétaire pour décrire un atome. En effet, la masse du système solaire est essentiellement concentrée dans le Soleil tout comme celle de l’atome est concentrée dans le noyau. Il propose donc comme modèle un tout petit noyau chargé positivement et comportant l’essentiel de la masse de l’atome, autour duquel les électrons décrivent des orbites.
Depuis, d’autres modèles plus complexes ont permis d’expliquer de nombreux autres phénomènes. Le modèle actuel de l’atome est l’aboutissement d’une longue histoire au cours de laquelle les représentations qu’on s’en fait ont profondément évolué.
2) Structure de l’atome.
• Les atomes sont les constituants de la matière. Ce sont des particules extrêmement petites car leur dimension est de l’ordre du dixième de nanomètre soit 10-10 m.
• 1 nm = 10-9 m (1 milliardième de m).
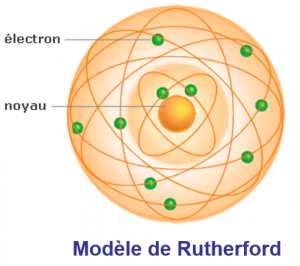
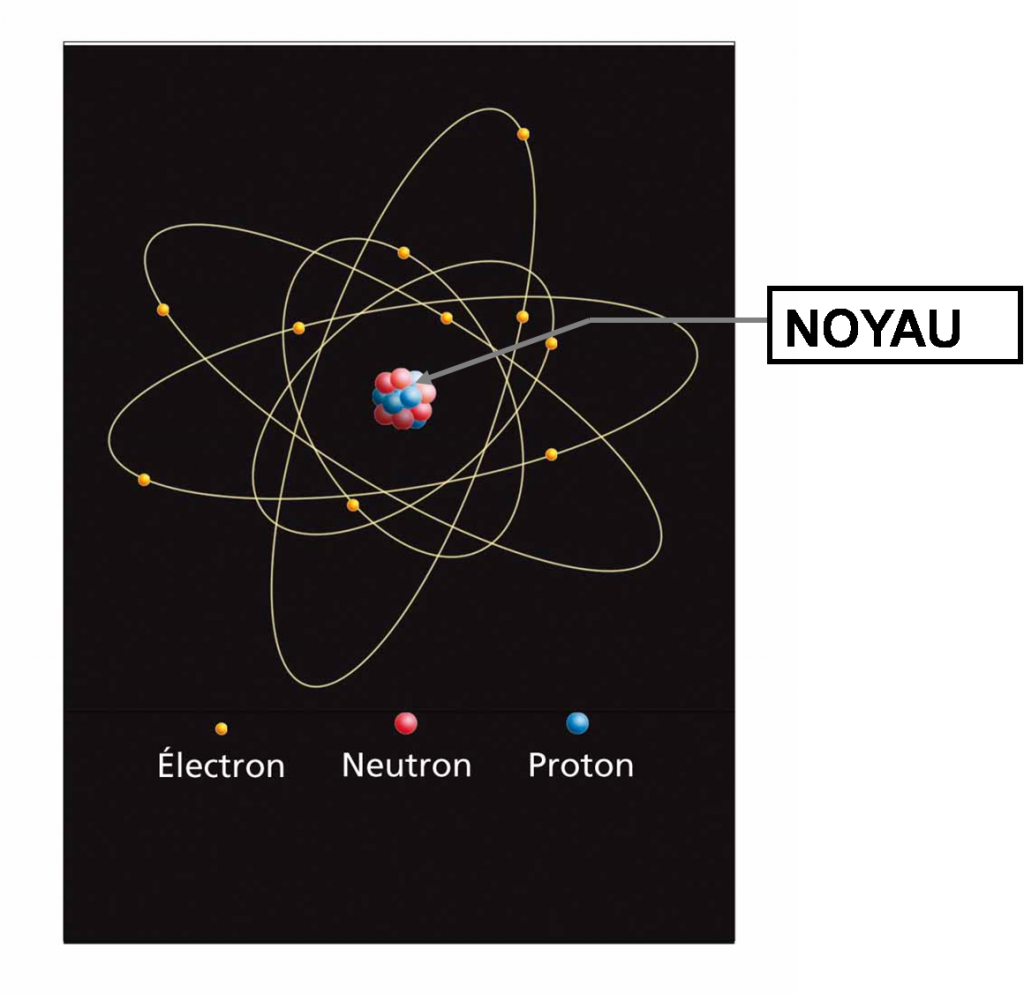
• Un atome est constitué d’un noyau autour duquel tournent des électrons.
Les électrons :
• Chaque électron porte une seule charge négative.
• Ils sont tous identiques.
• Ils forment le nuage électronique.
• Ils ont une masse très faible (négligeable).
• Ils donnent sa taille à l’atome.
Le noyau :
• Contient des particules appelées nucléons : les protons qui sont de charge positive, et les neutrons, qui sont électriquement neutres.
• Contient presque toute la masse de l’atome.
• A une dimension de l’ordre de 10-15 m, le noyau est donc 100000 fois plus petit que l’atome.
L’atome est électriquement neutre : le nombre de charges positives du noyau est donc égal au nombre de charges négatives des électrons.
Il y a donc autant de protons que d’électrons dans un atome.
Un atome est essentiellement constitué de vide : on dit qu’il a une structure lacunaire.
II – La classification périodique des éléments
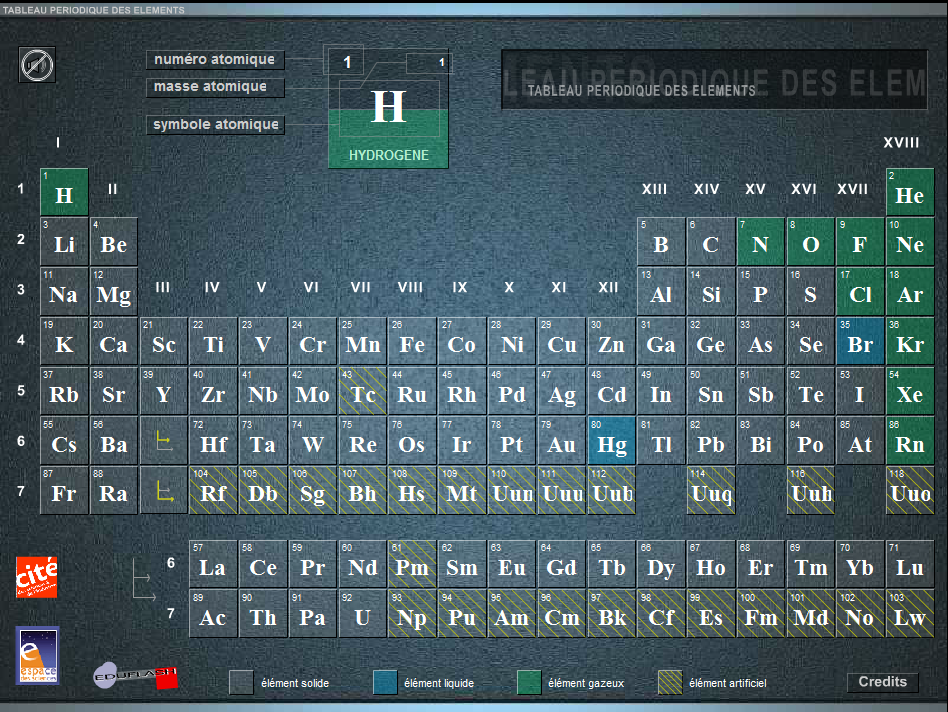
Tous les atomes sont classés dans un tableau appelé classification périodique des éléments chimiques.
Dans ce tableau, les atomes sont représentés par leur symbole et classés par numéros atomiques croissants.
- Numéro atomique
Le numéro atomique Z correspond au nombre de protons que contient le noyau d’un atome.
- Représentation des atomes
La représentation symbolique d’un atome de symbole X, dont le noyau comporte Z protons et A nucléons, est noté :
L’atome d’aluminium se note :
 Cela signifie que le noyau de l’atome d’aluminium contient 13 protons et 27 nucléons.
Cela signifie que le noyau de l’atome d’aluminium contient 13 protons et 27 nucléons.
- Nombre de masse A :
Le nombre de masse A (ou masse atomique arrondie à l’unité la plus proche) est le nombre de nucléons que contient le noyau d’un atome.
- Composition d’un atome :
Grâce à la représentation symbolique d’un atome on peut déterminer la composition de cet atome.
En effet, un atome de représentation symbolique
![]() contient : Z protons, Z électrons et (A-Z) neutrons.
contient : Z protons, Z électrons et (A-Z) neutrons.
Exemple :
L’atome d’aluminium
![]() contient donc : 13 protons, 13 électrons et (27-13) = 14 neutrons.
contient donc : 13 protons, 13 électrons et (27-13) = 14 neutrons.
Composition des atomes
Quiz sur la composition des atomes…
Tableau de bord: Composition des atomes
| Position | Nom | Passé le | Points | Résultat |
|---|---|---|---|---|
| Chargement du tableau | ||||

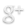










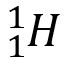
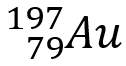
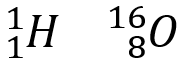
Ping :Sciences : De quoi est constitué une molécule, un atome, une particule ? | Eurêkoi
Cc
Merci ennormement pour ce cours enrichissant qui m’a vraiment aider a comprendre les element que javais pas compris dans m’a classe
Notre prof a voler votre cour
PLAIDEZ COUPABLE!!!!!!!!!!!!!
merci pour les explication
Très bien expliqué, merci pour le travail fait !