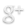L’air est uniquement situé dans une fine couche de quelques centaines de km d’épaisseur qui entoure notre planète. Cette couche d’air s’appelle l’atmosphère.
I – Composition de l’air :
LAVOISIER a réalisé la premiere analyse de l’air en 1777.
La composition actuelle de l’air sec est :
– 78% de diazote
– 21% de dioxygène
– 0,93% d’argon
– 0,034% de dioxyde de carbone
– de nombreux autres gaz en petite quantité…
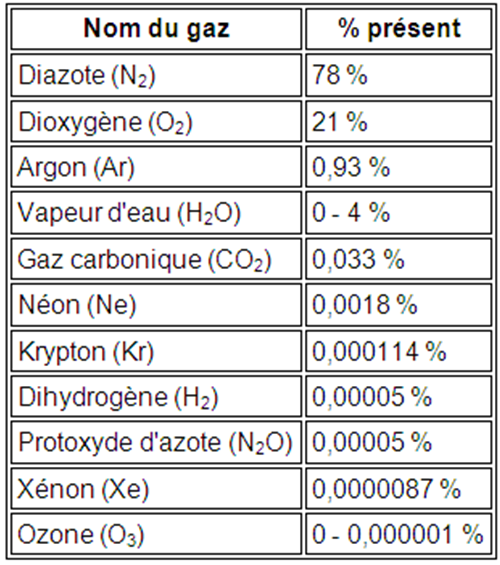 Les constituants les plus importants dont la quantité est variable dans le temps sont :
Les constituants les plus importants dont la quantité est variable dans le temps sont :
– la vapeur d’eau,
– le dioxyde de carbone,
– l’ozone,
– et certaines particules en suspension dans l’air.
II – Pression et volume de l’air.
1) Pression atmosphérique :
La pression atmosphérique se mesure avec un baromètre.

La pression d’un gaz enfermé (bouteille, pneus…) se mesure avec un manomètre.
L’unité de pression est le Pascal (Pa).
On utilise aussi couramment d’autres unités comme :
– l’hectopascal (hPa) 1 hPa = 100 Pa
– le bar (bar) 1 bar = 1000 hPa = 100000 Pa
La pression atmosphérique normale au niveau de la mer est de 1013 hPa.
– Si P > 1013 hPa : anticyclone (beau temps)
– Si P < 1013 hPa : dépression (mauvais temps)
La valeur de la pression atmosphérique varie en fonction de l’altitude et du temps qu’il fait.
Mesure de la pression
2) Compression et expansion :
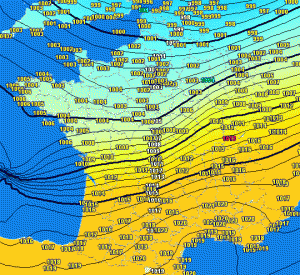
Expérience :
Prenons une seringue reliée à un capteur de pression .
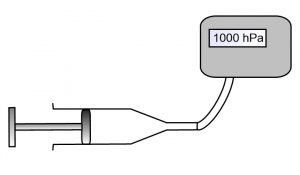
Comprimons l’air emprisonné dans la seringue. Observons.
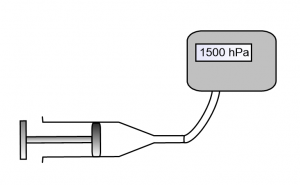
Tirons maintenant au contraire le piston de la seringue. Observons.
Observations :
Lorsque l’on comprime l’air son volume diminue et sa pression augmente.
Lorsque l’on détend l’air son volume augmente et sa pression diminue.
Conclusion :
L’air n’a pas de forme propre : il prend la forme du récipient et occupe la totalité du volume qui lui est offert
L’air qui est un mélange de gaz est compressible et expansible.
– Lorsque l’on comprime l’air, son volume diminue et sa pression augmente.
– Lorsque l’on détend l’air, son volume augmente et sa pression diminue.
Interprétation microscopique
La pression d’un gaz correspond à la force exercée par les molécules de ce gaz par unité de surface.
Elle dépend, entre autres, du nombre de chocs contre les parois et de la vitesse moyenne des molécules lors de ces chocs (donc de la température).
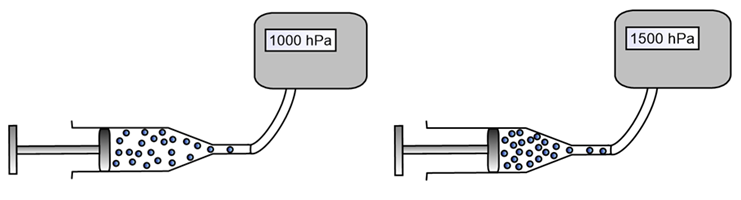 Lors d’une compression, le nombre de molécules ne change pas, mais le volume qu’elles occupent diminue. Le nombre de chocs contre les parois augmente alors et donc la pression augmente aussi.
Lors d’une compression, le nombre de molécules ne change pas, mais le volume qu’elles occupent diminue. Le nombre de chocs contre les parois augmente alors et donc la pression augmente aussi.
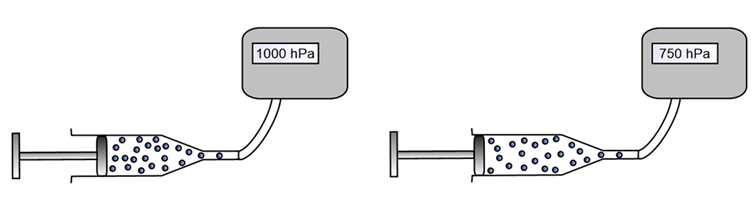 Lors d’une expansion (ou détente), le nombre de molécules ne change pas mais le volume qu’elles occupent augmente. Le nombre de chocs contre les parois diminue alors et donc la pression diminue aussi.
Lors d’une expansion (ou détente), le nombre de molécules ne change pas mais le volume qu’elles occupent augmente. Le nombre de chocs contre les parois diminue alors et donc la pression diminue aussi.
III – Masse de l’air :
Expérience 1 :
On pèse un ballon dégonflé et on trouve une masse mavant.
On gonfle alors le ballon à l’aide d’une pompe et on le pèse à nouveau. On trouve une masse maprès.
On remarque que maprès > mavant.
Conclusion 1 :
L’air possède une masse.
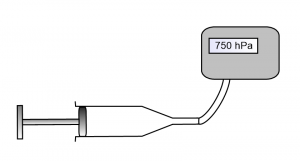
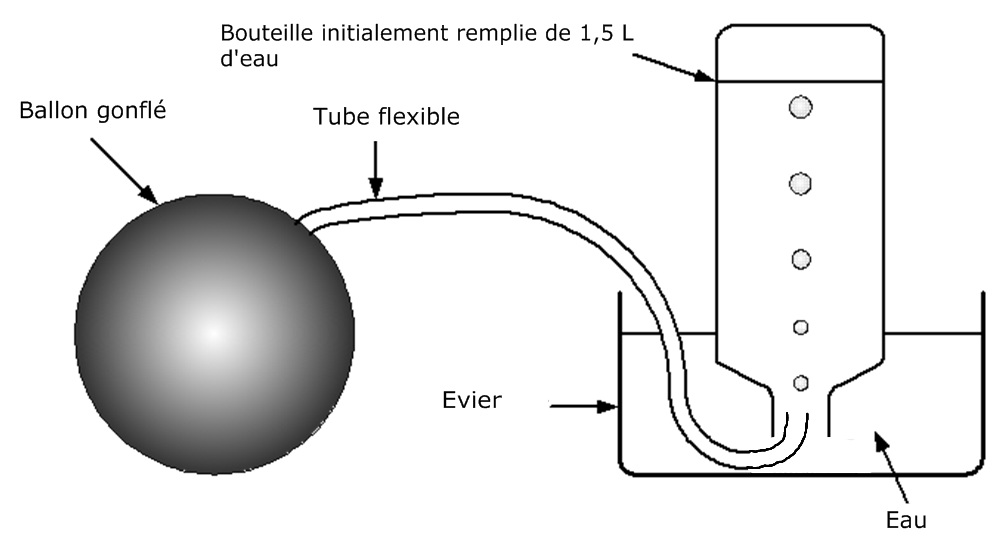
Expérience 2 : Détermination de la masse d’un litre d’air
D’après la vidéo de l’expèrience :
On pèse un ballon gonflé, et on trouve
mavant = 603 g
On vide 3 litres d’air du ballon dans la bouteille remplie d’eau grâce au dispositif ci-dessus.
On pèse alors le ballon dégonflé et on trouve :
maprès =599 g
La masse d’un litre d’air est alors :
m1Ld’air = (mavant – maprès ) : 3 = 4 g : 3 = 1,3 g
Conclusion :
La masse d’un litre d’air dépend de la température et de la pression.
A la pression atmosphérique normale et à la température de 25°C, la masse d’un litre d’air vaut environ 1,3 g.
Remarque :
L’air chaud est plus léger que l’air froid. Cela explique pourquoi les montgolfières, gonflées à l’air chaud, peuvent s’élever dans le ciel.
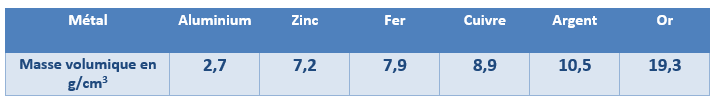
Masse volumique d’une substance :
La masse volumique est une grandeur physique caractérisant la masse d’une substance par unité de volume.
Elle se note ρ (rhô).
Dans les unités légales, la masse volumique est en kg/m3, mais dans la pratique on utilise plutôt le g/L ou le kg/L.
La masse volumique de l’air est ρ = 1,3 g/L à 25°C et 1013 hPa.
La masse volumique de l’eau est ρ = 1000 g/L = 1kg/L.
Calcul de la masse volumique d’une substance :
Si la masse est exprimée en kg et le volume en m3, alors la masse volumique sera en kg/m3.
Si la masse est exprimée en kg et le volume en L, alors la masse volumique sera en kg/L.
Si la masse est exprimée en g et le volume en cm3, alors la masse volumique sera en g/cm3…
Masse volumique
IV – Solubilité des gaz dans l’eau
La solubilité d’un gaz dans l’eau est le volume maximal de gaz que l’on peut dissoudre dans un litre d’eau.
Elle s’exprime alors en litre de gaz dissous par litre d’eau.
La solubilité d’un gaz dans l’eau dépend de la température et de la pression.
À température constante, la solubilité d’un gaz dans l’eau augmente avec la pression.
À pression constante, la solubilité de ce gaz diminue avec la température.
Remarque :
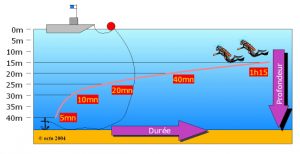
Lors d’une plongée, le dioxygène et le diazote de l’air sont d’autant plus dissous dans le sang que la pression est importante.
Le dioxygène est consommé par le corps humain. Le diazote ne l’est pas.
Lors d’une remontée trop rapide, la pression diminue brutalement et il peut se former des bulles dans le sang qui peuvent s’avérer mortelles…