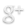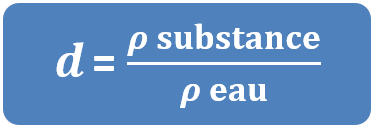I – Les métaux de la vie quotidienne
Un métal :
- est un matériau brillant lorsqu’il est poli ;
- est un bon conducteur de l’électricité ;
- est un bon conducteur de la chaleur.
Les métaux les plus couramment utilisés sont :
| Métal | Caractéristiques | Utilisation |
|
Or (5000 ans A.V.J.C.) |
Ne s'oxyde pas, rare, cher et déformable |
Bijoux Panneaux réfléchissants modules spatiaux Technologie de pointe |
|
Argent (3500 ans A.V.J.C.) |
Très bon conducteur électrique et réflecteur de lumière S'oxyde rapidement |
Circuits électroniques Bijoux Miroirs |
|
Cuivre (3000 ans A.V.J.C.) |
Très bon conducteur électrique et thermique |
Fils électriques Conduites d’eau Chaudières |
|
Fer (1000 ans A.V.J.C.) |
Solide, abondant et peu couteux S'oxyde rapidement (rouille) |
Construction métallique Rails, ponts, charpentes… |
|
Zinc (XVIème s.) |
Très résistant à l'eau |
Plaques couverture toit Gouttières Automobiles |
|
Aluminium (XVIIIème s.) |
Léger et résistant Quasi inaltérable |
Ustensile de cuisine, emballage alimentaire, Aéronautique |
Ces métaux sont souvent mélangés à d’autres espèces chimiques afin d’améliorer leurs propriétés : on appelle ces mélanges des alliages.
Exemples :
Acier = fer + carbone
Bronze : cuivre + étain
Laiton : Zinc + cuivre
II – Tests de reconnaissance des métaux.
Test de couleur :
Le premier test possible est celui de la couleur du métal. Même si la plupart des métaux sont gris, ce test permet de distinguer certains métaux comme l'or (jaune) ou le cuivre (rouge-marron).
Test à l’aimant :
Seul le fer est attiré par un aimant.
Test de densité (ou masse volumique)
Les métaux sont plus ou moins denses (plus ou moins lourds par unité de volume). On peut donc les caractériser grâce à ce test.
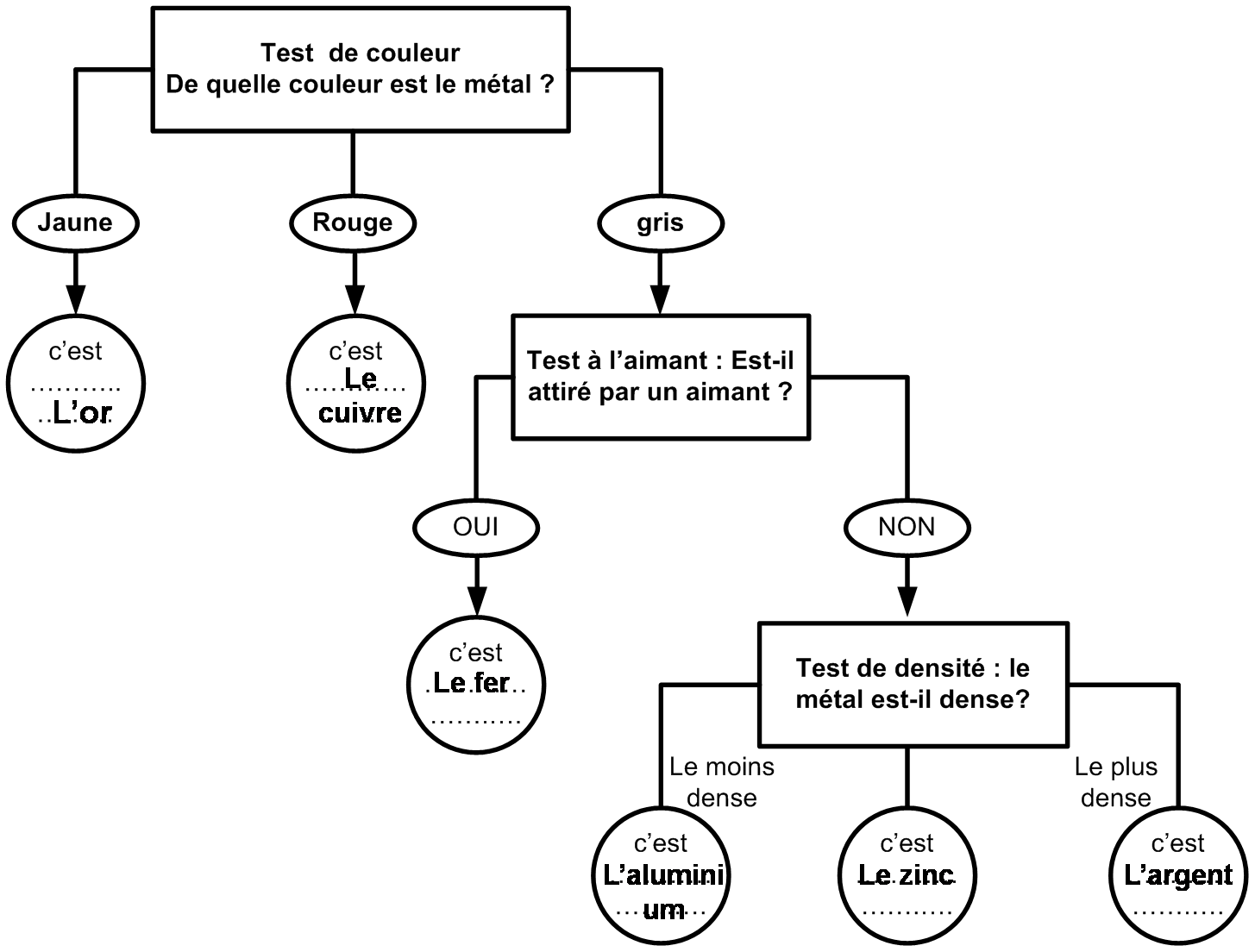
On peut aussi différencier les métaux grâce à un test de corrosion.
Que se passe-t-il si le métal reste dans l’air humide un certain temps ?
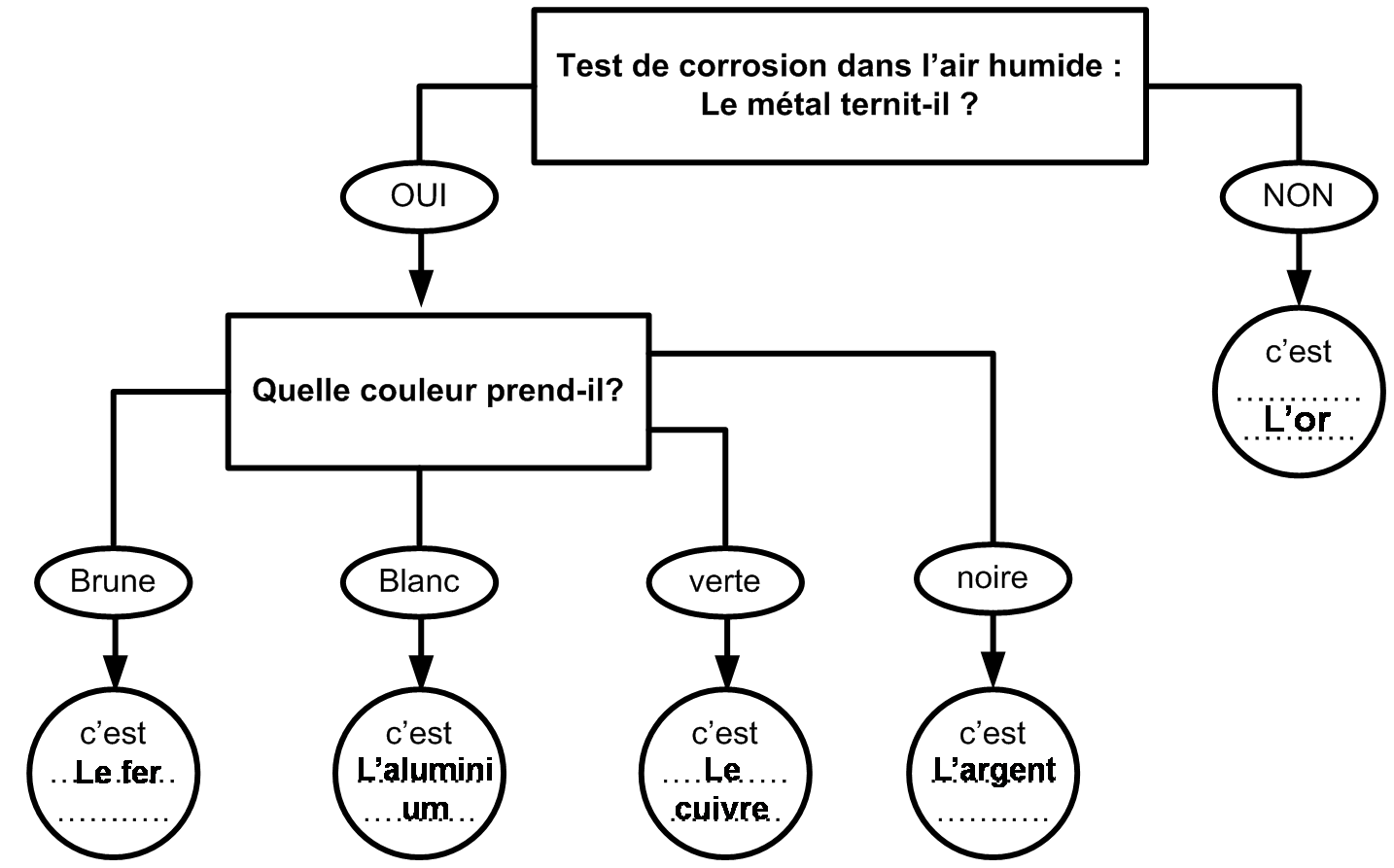
Calcul de la masse volumique d'un métal :
La masse volumique d'une substance correspond à la masse de cette substance par unité de volume (cm3, L ou m3).
Pour déterminer la masse volumique d'un échantillon de métal, il faut connaître la masse de l'échantillon ainsi que son volume.
Alors, la masse volumique, notée ρ (se dit rhô), de ce métal se calcule ainsi :
- Elle est exprimée en kg / L si la masse est exprimée en kg et le volume en L.
- Elle est exprimée en kg /m3 si la masse est exprimée en kg et le volume en m3.
- Elle est exprimée en g / cm3 si la masse est exprimée en g et le volume en cm3.
Exemples :
On a vu en cinquième que la masse d'un litre d'eau est de 1kg, donc la masse volumique de l'eau est : ρeau = 1 kg/L = 1 g/cm3.
On a vu en quatrième que la masse d'un litre d'air était de 1,3 g, donc la masse volumique de l'air est dont : ρair = 1,3 g/L.
Chaque métal a sa propre masse volumique. La connaissance de cette valeur nous permet donc de l'identifier.
Dans certains cas, on utilisera la notion de densité qui correspond à la valeur de la masse volumique ( en g/cm3 ou kg/L) mais s'exprime sans unité.
La densité se note d et se calcule de la façon suivante :
- La masse volumique de l'or est de 19,3 kg/L et celle de l'eau est de 1 kg/L, donc la densité de l'or est :
dor = ρor / ρeau = 19,3 / 1 = 19,3.
- La masse volumique de l'aluminium est de 2,7 g/cm3 et celle de l'eau est de 1 g/cm3, donc la densité de l'aluminium est :
daluminium = ρaluminium/ ρeau = 2,7 / 1 = 2,7
- La densité de l'eau est donc : deau = ρeau / ρeau = 1 / 1 = 1..
Remarque :
Une substance qui possède une densité supérieure à celle de l'eau, coulera dans l'eau.
A l'inverse, une substance qui possède une densité inférieure à celle de l'eau (et qui ne se mélange pas à l'eau), flottera sur l'eau.
Les métaux de la vie quotidienne
| Je sais que |
| Les métaux les plus couramment utilisés sont le fer, le zinc, l’aluminium, le cuivre, l’argent et l’or. |
| Je suis capable de : |
| Distinguer quelques métaux usuels. |
| Repérer quelques unes de leurs utilisations par observation et à partir d’informations. |
III – Réaction entre le fer et l’acide chlorhydrique
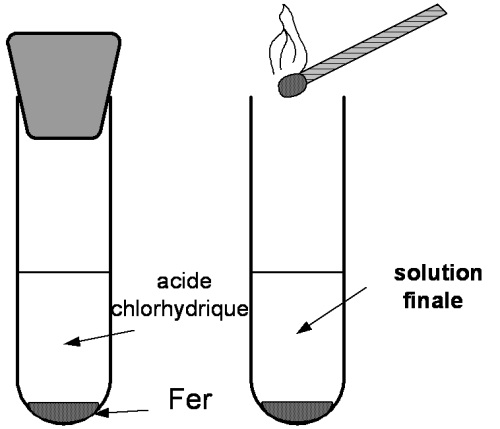
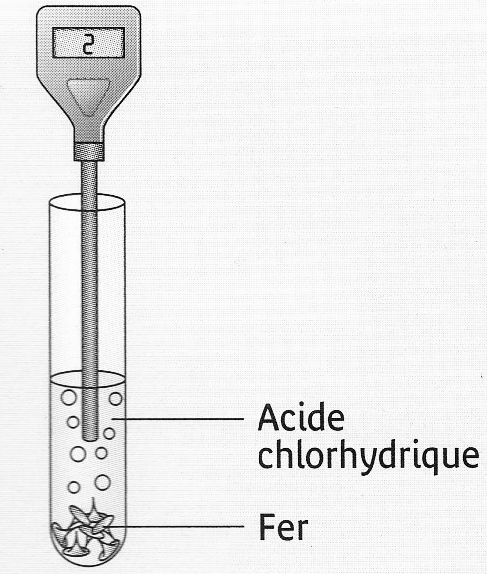
- Expérience :
Dans un tube à essais grand modèle, mettre environ 2 pointes de spatule de Fer (Fe) en poudre; puis ajouter environ 5 cm d’acide chlorhydrique et boucher.
Quand la pression est forte approcher une flamme.
- Observations :
Pendant, la réaction, on observe une vive effervescence.
En présentant la flamme, on entend "un pop" qui caractérise la présence du gaz dihydrogène.
On observe aussi la disparition d’une partie du fer et que le pH augmente au cours de la réaction.
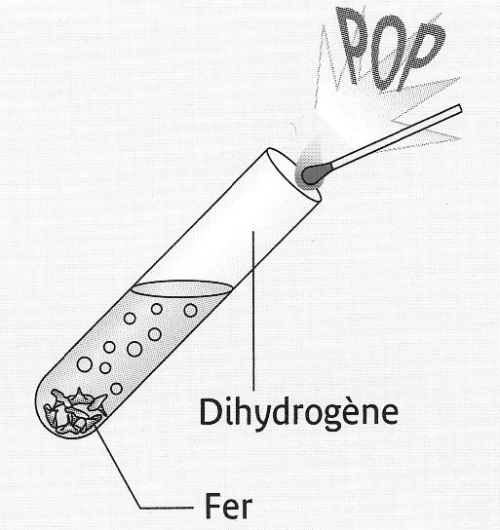
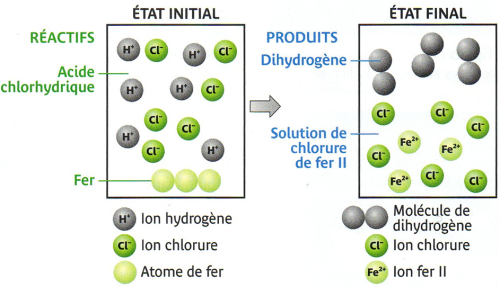
 Interprétation :Une réaction chimique a eu lieu : le fer est un réactif alors que le dihydrogène est un produit.
Interprétation :Une réaction chimique a eu lieu : le fer est un réactif alors que le dihydrogène est un produit.
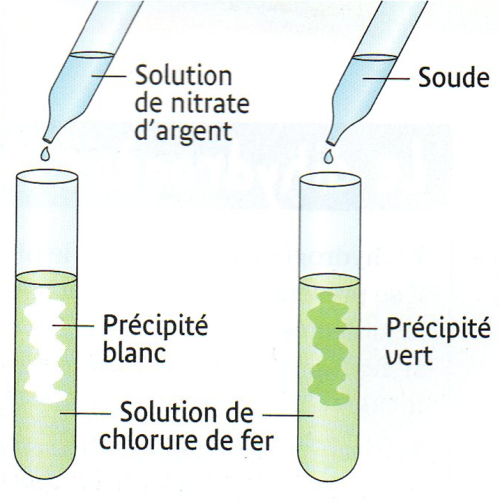
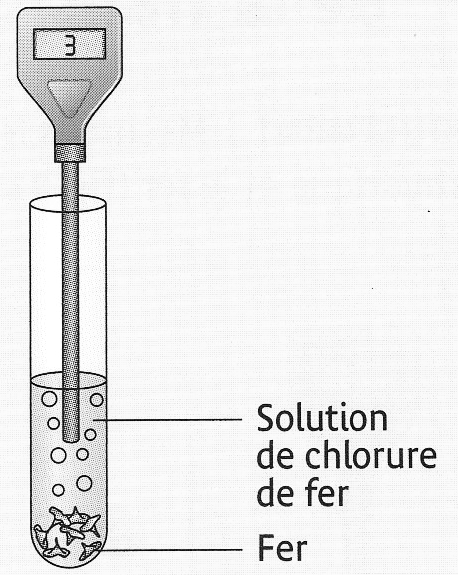
- Analyse de la solution après la réaction :
On récupère la solution après filtration et on réalise deux tests.
Test à la soude : il se forme un précipité vert qui caractérise la présence d’ions fer II : Fe2+.
Test au nitrate d’argent : il se forme un précipité blanc qui caractérise la présence d’ions chlorure Cl–
Interprétation :
La solution obtenue qui contient des ions chlorure et des ions fer II est une solution de chlorure de fer II.
Conclusion :
On peut écrire le bilan suivant :
Fer + acide chlorhydrique → dihydrogène + chlorure de fer II
Remarques :
• Les ions chlorures sont présents en même quantité avant et après la réaction, donc ils ne participent pas à la réaction : ce sont des ions spectateurs.
• Le pH a augmenté donc ce sont les ions H+ qui ont disparu et réagi avec le fer.
• On en déduit que les réactifs de cette réaction sont le fer et les ions hydrogène alors que les produits sont le dihydrogène et les ions fer II.
On peut donc écrire un nouveau bilan :
Fer + ions hydrogène → Dihydrogène + ions fer II
Et l’équation-bilan de la réaction du fer avec l’acide chlorhydrique sera :
Fe + 2H+ → H2 + Fe2+
Action d’un produit de nettoyage sur l’acier.
Félicitation - vous avez complété Action d’un produit de nettoyage sur l’acier..
Vous avez obtenu %%SCORE%% sur %%TOTAL%%.
Votre performance a été évaluée à %%RATING%%
Action de l'acide chlorhydrique sur un métal inconnu :
Action de l'acide chlorhydrique sur le magnésium.
Félicitation - vous avez complété Action de l'acide chlorhydrique sur le magnésium..
Vous avez obtenu %%SCORE%% sur %%TOTAL%%.
Votre performance a été évaluée à %%RATING%%