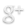I – Mélanges et corps pur
1) Les corps purs
Un corps pur est formé d’une seule substance, d’une seule espèce chimique.
Exemples :
L’eau déminéralisée est un corps pur car elle ne contient que des molécules d’eau. Le gaz dioxygène contenu dans une bouteille d’oxygène est un corps pur car il ne contient que des molécules de dioxygène.
2) Les mélanges
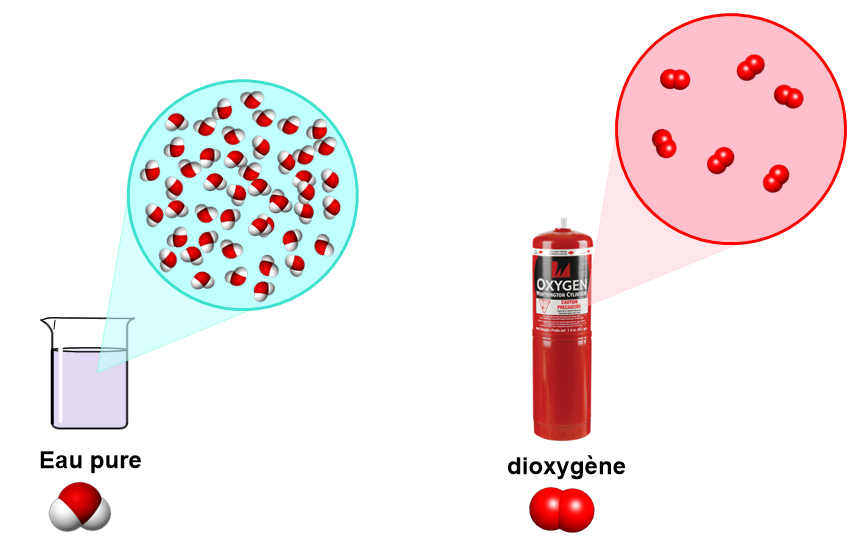
Un mélange est une substance composée de plusieurs constituants différents.
Il existe deux types de mélanges :
- Un mélange hétérogène est un mélange pour lequel on peut distinguer au moins 2 constituants à l’œil nu.
Exemples : jus d’orange, eau boueuse, eau+huile,boissons gazeuses,…
- Un mélange homogène est un mélange pour lequel on ne distingue pas les différents constituants à l’œil nu.
Exemples : eau sucrée, eau salée, sirop, lait,….
II – Séparation des constituants d’un mélange hétérogène.
1) La décantation.
Matériel : un tube à essais, de l’eau boueuse.
Manipulation : On laisse reposer pendant un temps suffisamment long l’eau boueuse dans un tube à essais.

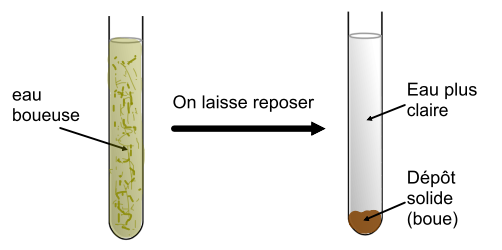 Observation : Les particules solides et lourdes se déposent au fond du tube. Le liquide au-dessus du dépôt est limpide et plus clair.
Observation : Les particules solides et lourdes se déposent au fond du tube. Le liquide au-dessus du dépôt est limpide et plus clair.
Conclusion :
La décantation est une méthode de séparation des mélanges hétérogènes.
Elle consiste à laisser reposer le mélange pour que les particules solides et lourdes se déposent sous l’effet de leur poids.
Applications :
La décantation est utilisée pour le traitement des eaux usées dans les stations d’épuration, pour les analyses sanguines, pour séparer la pulpe du jus du fruit,…
2) La centrifugation.
La centrifugation consiste à faire tourner très vite le récipient contenant le mélange hétérogène.
Observations (centrifugeuse à l’arrêt) :
Dans chaque tube, après la rotation, on observe au fond un dépôt solide et au-dessus un liquide plus clair.

La centrifugation est une méthode de séparation qui ressemble à la décantation mais qui est bien plus rapide.
Conclusion : La décantation et la centrifugation permettent de séparer des constituants d’un mélange hétérogène.
Applications :
La centrifugation est utilisée dans les analyses sanguines, pour essorer les salades ou le linge, pour extraire le jus des fruits ou des légumes, …
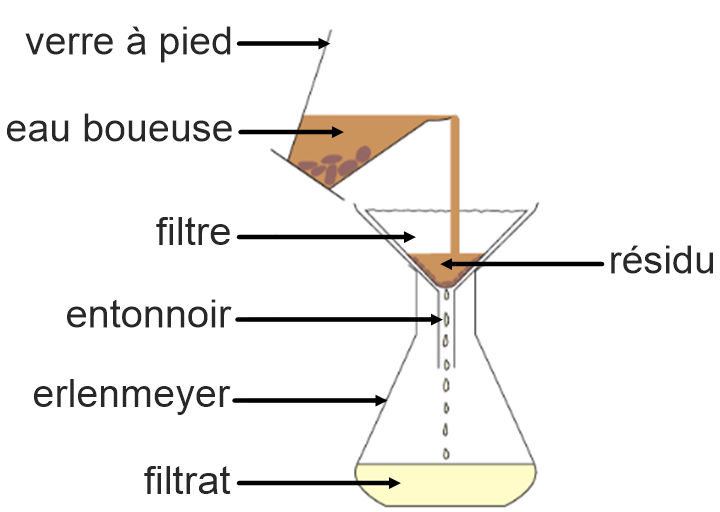
3) La filtration.
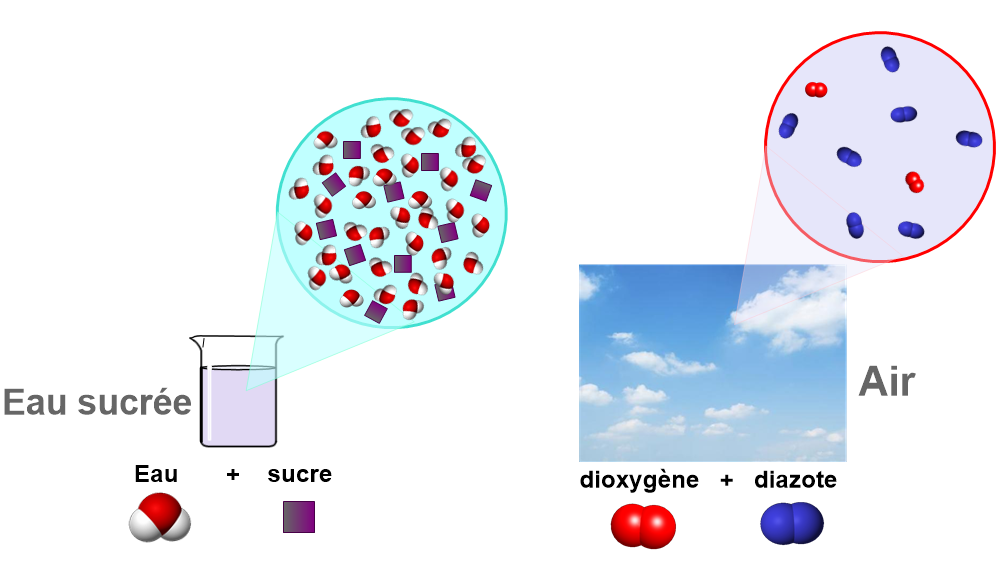
Matériel : un entonnoir, papier Filtre, verre à pied, erlen.
Manipulation : On verse lentement de l’eau boueuse dans un filtre placé dans un entonnoir. On place l’entonnoir au-dessus d’un erlen.
Observations :
Un liquide s’écoule peu à peu. Les particules solides sont retenues par le filtre. C’est le résidu.
Au fond du bécher, le liquide recueilli est homogène. On l’appelle filtrat.
Interprétation :
Le papier filtre est percé de petits trous. Il laisse passer les liquides et arrête les particules solides plus grosses que les trous.
Conclusion :
La filtration permet d’obtenir un mélange homogène à partir d’un mélange hétérogène.
Applications :
La filtration est utilisée dans le traitement de l’eau, pour préparer du café, du thé, pour nettoyer l’eau d’une piscine, ….
4) les gaz dissous dans les boissons.
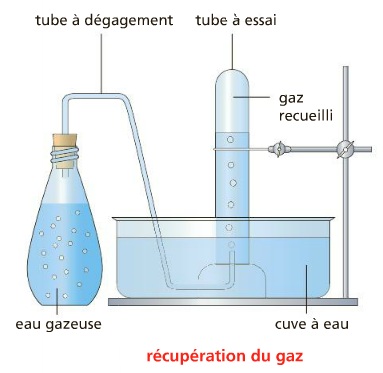
a) Récupération du gaz.
Expérience :
Du gaz s’échappe de la bouteille d’eau gazeuse, passe par le tube à dégagement puis monte dans le tube à essai en prenant la place de l’eau.
La technique utilisée s’appelle recueil d’un gaz par déplacement d’eau.
b) Identification de ce gaz.
Le gaz était dissous dans la boisson, il est incolore.
Expérience :
On verse de l’eau de chaux dans le tube contenant le gaz, on bouche et on agite.
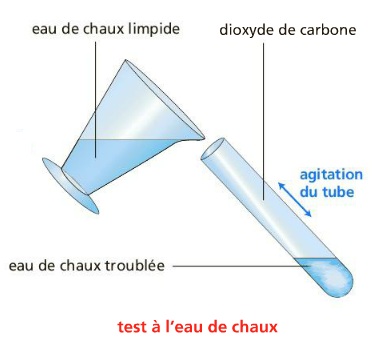
Observation:
L’eau de chaux se trouble.
Rappel : L’eau de chaux se trouble en présence de dioxyde de carbone
Conclusion :
Toutes les boissons gazeuses contiennent du dioxyde de carbone dissous qui trouble l’eau de chaux.
Les mélanges aqueux
III – Les solides dissous dans l’eau
1) Les solides dissous dans l’eau
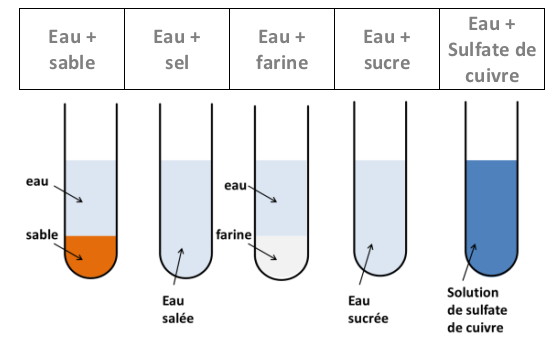
Expérience :
On verse de l’eau dans plusieurs tubes à essai puis on y ajoute plusieurs solides. On agite et on laisse reposer.
Observations :
Après agitation, on observe que certains solides disparaissent (sel, sucre, sulfate de cuivre,…) et d’autres pas (farine,sable,..).
Interprétation :
Les solides qui peuvent se dissoudre dans l’eau sont dits : solubles dans l’eau.
Les autres sont dits insolubles dans l’eau.
Le mélange homogène obtenu par dissolution dans l’eau est une solution aqueuse.
Le sel, sucre,… sont les solutés et l’eau est le solvant.
Lorsqu’on veut dissoudre une quantité trop importante de sel dans l’eau, celui-ci ne se dissout plus : on dit que la solution est saturée en sel.
CONCLUSION :
Solubilité
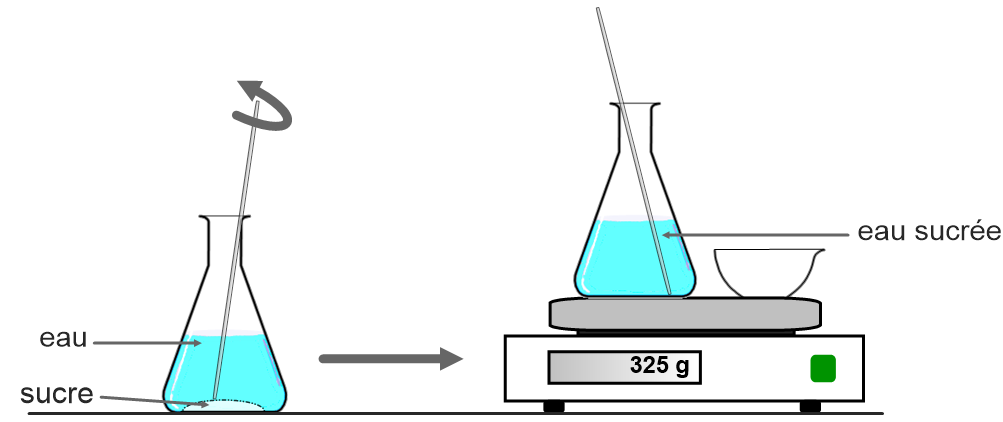
2) Conservation de la masse au cours d’une dissolution
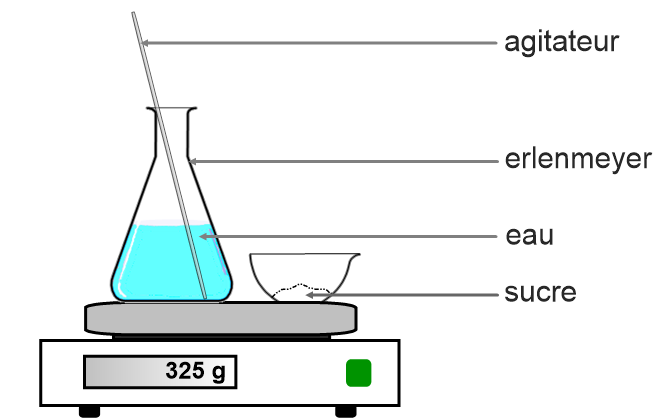
Expérience :
On place sur le plateau d’une balance une coupelle contenant du sucre et un erlenmeyer contenant de l’eau. On relève la masse.
Puis on met le sucre dans l’eau et on mélange. On note à nouveau la masse.
On peut réaliser la même expérience avec du sel ou du sirop.
Remarque : Il n’est pas nécessaire de réaliser de Tare pour enlever la masse de l’erlen et de la coupelle car on veut simplement vérifier si la masse totate varie lors de la dissolution du sucre dans l’eau.
Observation :
La masse ne change pas lors de la dissolution du sucre.
CONCLUSION :
La masse d’un mélange est égale à la masse des substances mélangées.
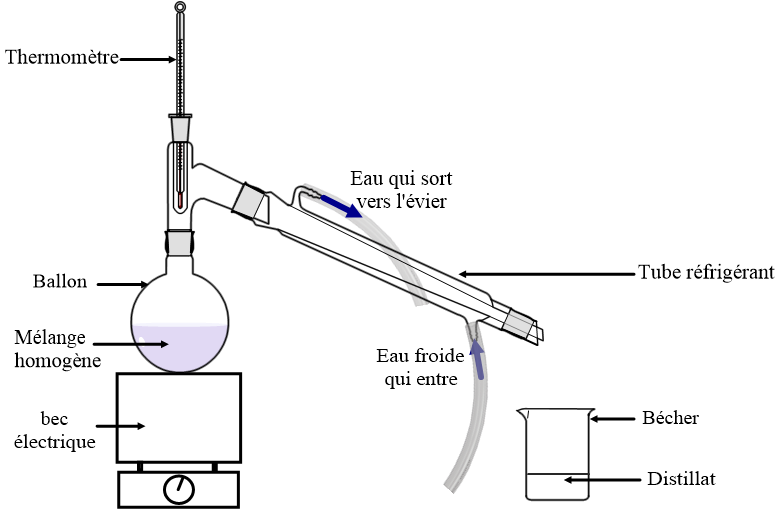
3) Séparation des constituants d’un mélange homogène : la distillation
Expérience :
On place un mélange homogène (eau salée) dans le ballon de ce dispositif et on chauffe le mélange.
Observations :
Le mélange se met à bouillir et de la vapeur (d’eau) s’élève et passe dans le tube réfrigérant.
Cette vapeur se refroidit brutalement au contact des parois froides du réfrigérant à eau et elle se liquéfie.
Des gouttes d’eau pure se forment et tombent dans le bécher.
Le distillat (résultat de la distillation) ne contient plus de sel car le sel ne s’est pas évaporé.
Bilan de la distillation:
Il reste dans le ballon tous les composés solides initialement dissous dans l’eau.
Le distillat aussi appelé eau distillée est formée d’eau quasiment pure.
Conclusion :
La distillation permet de séparer les constituants d’un mélange homogène.
Remarque: il existe des techniques de distillations plus complexes qui permettent des séparer des mélanges homogènes de liquides (obtention d’eau de vie à partir du vin,…).
Applications :
La distillation est utilisée pour le dessalement de l’eau de mer, pour séparer les différents constituants du pétrole, pour récupérer les huiles essentielles (parfumerie), pour la fabrication de certains alcools,…
III – Les mélanges de liquides
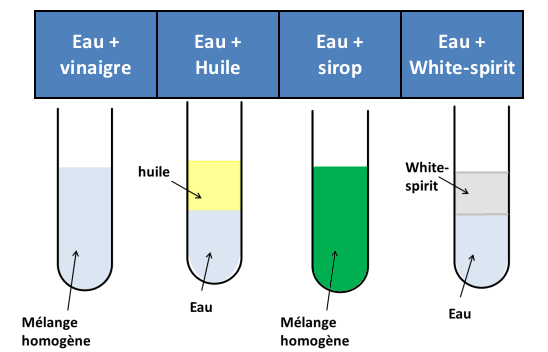
Expérience 1:
On verse de l’eau dans plusieurs tubes à essai puis on y ajoute plusieurs liquides. On agite puis on laisse reposer.
Observations :
Le vinaigre et le sirop forment avec l’eau un mélange homogène : on dit qu’il sont miscibles à l’eau.
L’huile et le white-spirit ne forment pas un mélange homogène avec l’eau : ils sont non miscibles à l’eau.
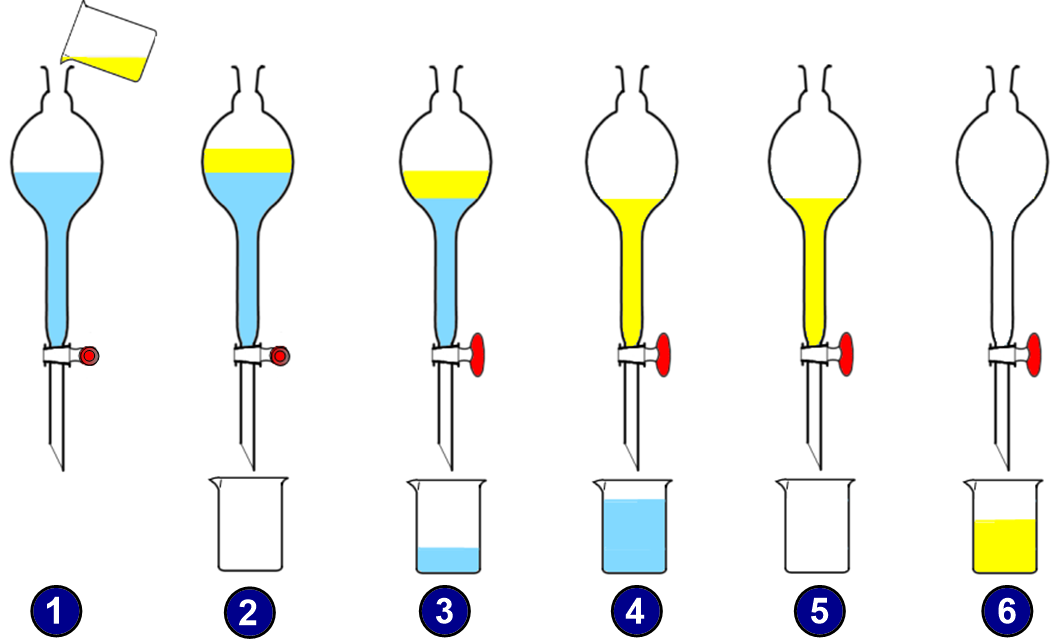
Expérience 2 :
On souhaite séparer le mélange eau + huile. Pour cela il suffit de verser le mélange eau+ huile dans une ampoule à décanter (1) et laisser reposer le mélange (2). On observe une décantation.
Après avoir enlevé le bouchon de l’ampoule à décanter, on ouvre le robinet et on laisse couler l’eau dans le bécher (3) jusqu’à ce que la surface de séparation « eau-huile » arrive au niveau du robinet (4).
Dans le bécher, on a récupéré l’eau, puis il ne reste plus qu’à verser l’huile dans un autre bécher (5) et (6).
La séparation est effectuée.
CONCLUSION :
De nombreux liquides sont miscibles à l’eau.
Les liquides non miscibles peuvent être séparés avec une ampoule à décanter.