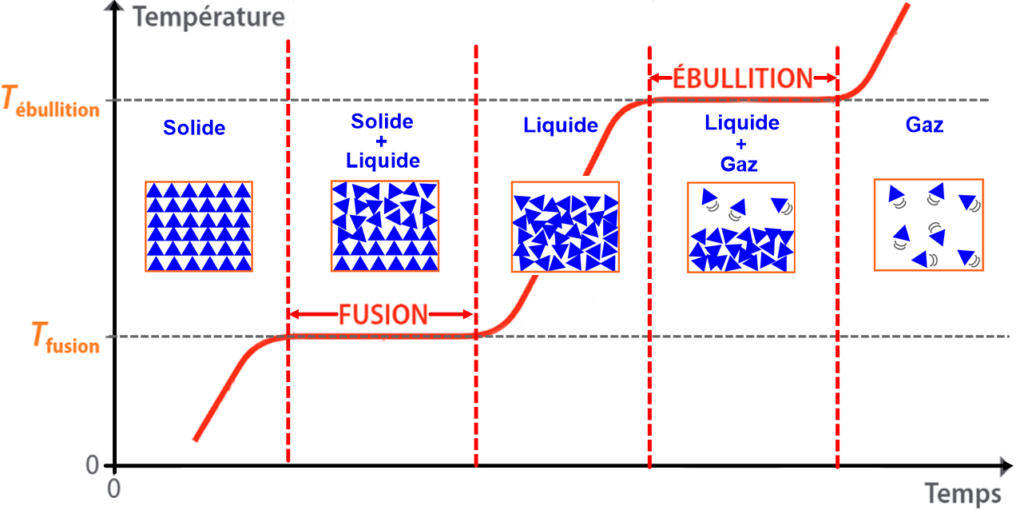
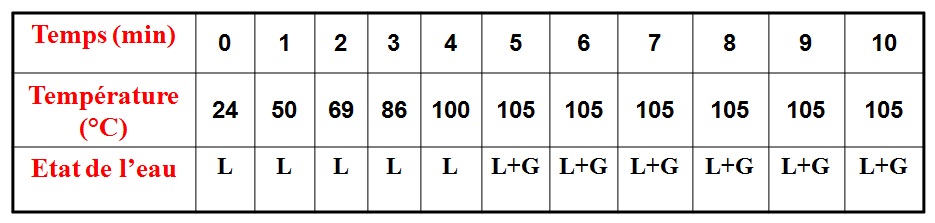
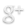I – Les changements d’états.

Remarques :
La vaporisation d’un liquide peut se faire soit :
- Par évaporation ( par exemple une flaque d’eau s’évapore rapidement au soleil)
- Par ébullition ( si on chauffe de l’eau, des bulles de vapeur d’eau se forment et l’eau bout).
II – Étude de la solidification de l’eau pure
Expérience:
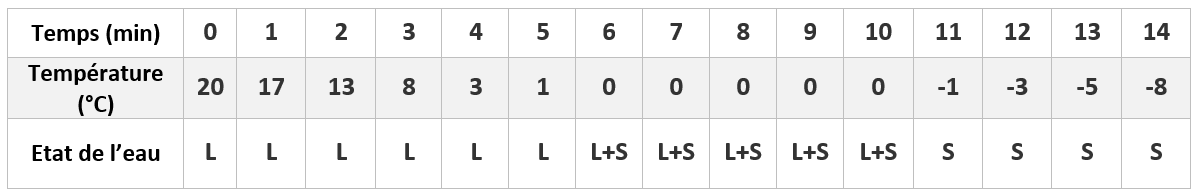
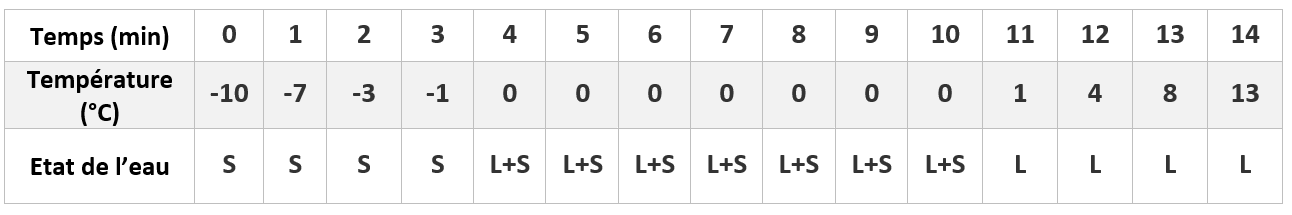
On place un tube à essais, contenant de l’eau distillée, dans un mélange réfrigérant.
On observe le contenu du tube, et on relève la température toutes les minutes.
L : LIQUIDE ; L+S : LIQUIDE +SOLIDE ; S: SOLIDE
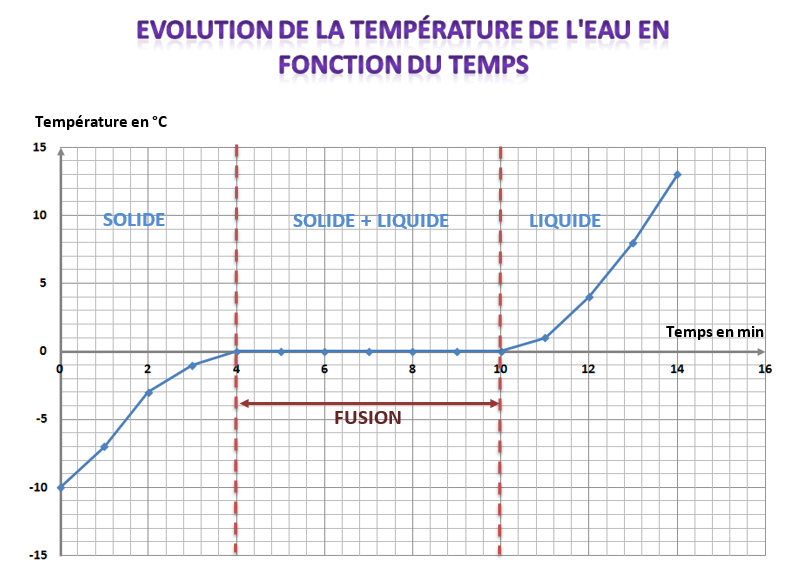
On trace alors le graphique de la température de l’eau en fonction du temps écoulé :
Observations :
L’eau commence à se solidifier à 0°C et la température reste constante pendant toute la durée du changement d’état.
La courbe d’évolution de la température au cours du temps présente un palier de température.
Quand l’eau est entièrement transformée en glace, la température baisse à nouveau.
Conclusion:
Durant la solidification de l’eau PURE, la température reste constante, égale à : 0°C, c’est la température de solidification de l’eau pure.
Le changement d’état d’un corps pur s’effectue à température constante.
Cette température nous permet d’identifier le corps pur.
III – solidification d’un mélange
Préparons de l’eau salée, puis refroidissons ce mélange.
On relève alors toutes les minutes la température et on trace le graphe donnant l’évolution de la température en fonction du temps.
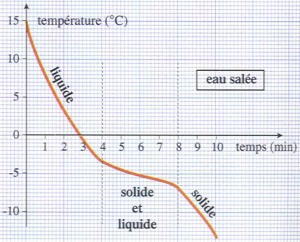 Durant la solidification du mélange, la température ne reste pas constante : il n’est pas possible de définir une température de solidification d’un mélange.
Durant la solidification du mélange, la température ne reste pas constante : il n’est pas possible de définir une température de solidification d’un mélange.
IV – Étude de la fusion de l’eau.
Expérience:
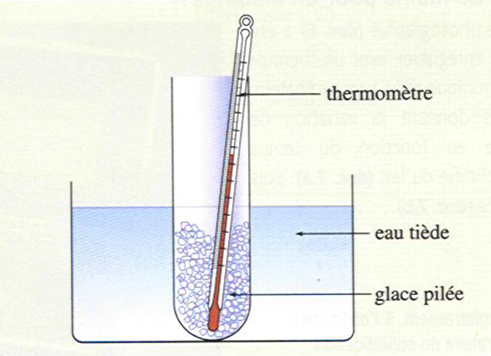
Plaçons un tube à essais contenant de la glace pilée dans de l’eau tiède.
Relevons alors la température dans le tube toutes les 30 secondes en procédant comme dans l’expérience précédente.
On trace alors un graphique représentant la variation de température en fonction du temps.
Observations :
L’eau commence à se fondre à 0°C et la température reste constante pendant toute la durée du changement d’état.
La courbe d’évolution de la température au cours du temps présente un palier de température.
Quand la glace est entièrement transformée en eau liquide, la température augmente à nouveau.
Conclusion:
Durant la fusion de la glace, la température reste constante, égale à 0°C (température de fusion de l’eau).
La fusion et la solidification de l’eau pure se produisent à la même température : 0°C.
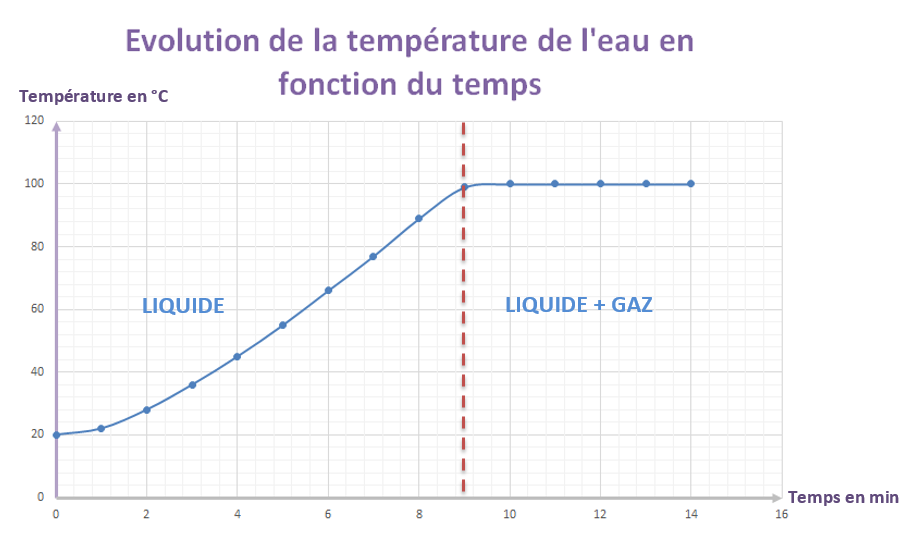
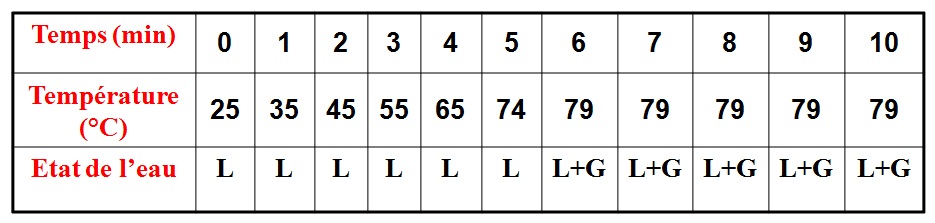
V – Étude de l’ébullition de l’eau pure
Si on chauffe un liquide, on observe, qu’à partir d’une certaine température de grosses bulles de vapeur prennent naissance dans le liquide et s’échappent à la surface. L’ébullition est donc le passage de l’état liquide à l’état gazeux.
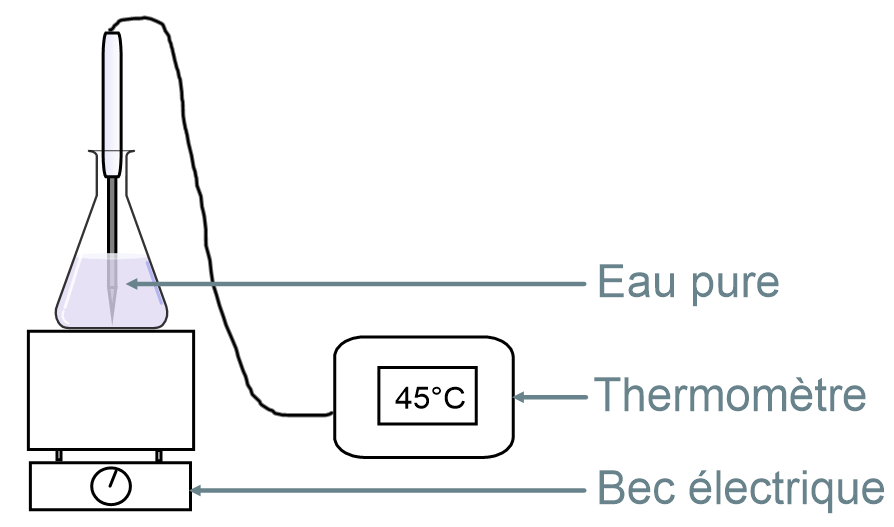
Expérience:
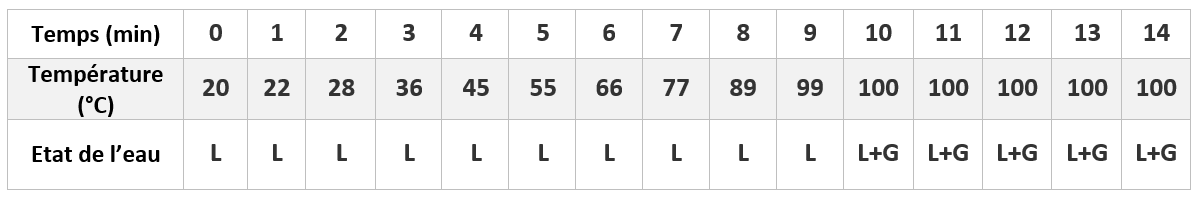
On fait chauffer de l’eau pure dans un erlen à l’aide d’un bec électrique et on relève la température de l’eau toutes les minutes.
L : LIQUIDE
L+G : LIQUIDE + GAZ
On trace un graphique représentant la variation de température en fonction du temps.
Observations:
lorsque l’on chauffe l’eau pure:
– la température de l’eau liquide s’élève;
– la température reste constante égale à 100°C, tandis que l’eau bout et se transforme en gaz.
Conclusion:
– La température reste constante au cours de l’ébullition d’un corps pur.
– 100°C est la température d’ébullition de l’eau pure.
Influence de la pression.
Expérience:
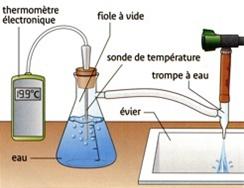 Observations:
Observations:
Si la pression diminue, l’eau bout à une température inférieure à 100°C.
Conclusion:
La température d’ébullition de l’eau dépend de la pression .
L’eau pure ne bout à 100°C que sous la pression atmosphérique normale (1013 hPa).
En haute montagne, à 4000 m d’altitude par exemple, la pression est plus faible; la température d’ébullition de l’eau n’est que de 85°C : la cuisson des aliments est donc plus lente!
En revanche, dans un autocuiseur fermé et chauffé, la pression est élevée; l’eau bout à une température supérieure à 100°C. Cela permet de cuire rapidement les aliments!
Exemples de températures d’ébullition de corps purs sous la pression atmosphérique normale :
- Alcool : 79°C
- Mercure : 357°C
- Fer : 2750°C
Conclusion:
Sous une pression donnée, les températures de changement d’état d’un corps pur caractérisent ce corps et permettent de l’identifier.
VI – Masse et volume lors d’un changement d’état
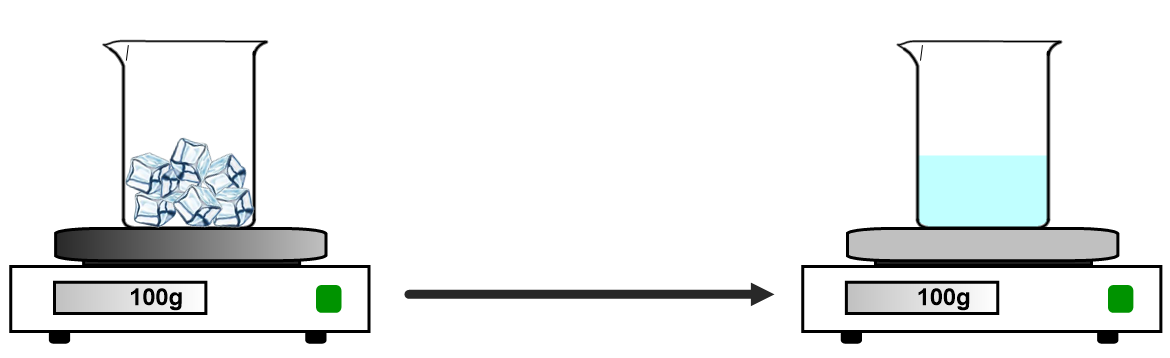
1) La masse varie-t-elle au cours d’un changement d’état ?
Expérience :
Observation
Lorsque la glace fond, la masse ne varie pas
Conclusion :
La masse d’une substance ne varie pas lors d’un changement d’état.
2) Le volume change-t-il au cours d’un changement d’état ?
Exemple :
Si on place une bouteille remplie d’eau et bouchée dans un congélateur, la bouteille se brise. En effet, lorsque l’eau se solidifie, le volume qu’elle occupe augmente.
Conclusion :
Le volume d’une substance varie lors d’un changement d’état.
VII – Interprétation microscopique des changements d’état de l’eau
L’eau est formée de molécules toutes identiques.
Les molécules d’eau sont d’autant plus agitées que la température est élevée.
Si la température augmente, les changements d’état ont lieu car le désordre augmente.
Lors d’un changement d’état, l’arrangement des molécules change, donc le volume varie.
Lors d’un changement d’état, la masse ne varie pas car le nombre de molécules ne varie pas.