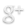I – Quels sont les états de l’eau sur Terre ?
Environ les 3/4 de notre planète (70,7% ) sont recouverts par les mers et les océans.
L’ensemble des réserves d’eau de la Terre s’appelle l’hydrosphère.
Sur Terre, l’eau existe sous trois états :
- Solide : glaciers, banquise, givre, neige, grêle….
- Liquide (état de l’eau le plus abondant sur Terre) : océans, mers, lacs, pluie, rosée, brouillard, buée ….
- Gazeux : dans cet état l’eau est appelée vapeur d’eau et ce gaz est invisible. Cette vapeur d’eau se trouve partout dans l’air autour de nous.
Remarque : Les nuages ne sont pas de la vapeur d’eau mais ils sont constitués de minuscules gouttelettes d’eau liquide ou de cristaux de glace.
II – Mise en évidence de l’eau dans une substance
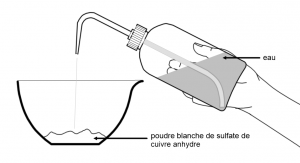
Le sulfate de cuivre anhydre est une poudre blanche qui devient bleue au contact de l’eau.
Le sulfate de cuivre anhydre est utilisé pour détecter la présence d’eau dans une substance.
Si au contact d’une substance le sulfate de cuivre anhydre devient bleu alors cette substance contient de l’eau.
III– Les caractéristiques de l’eau dans ses 3 états
1) L’état solide
Un solide a une forme qui lui est propre.
On peut les prendre avec les doigts.
Le volume d’un solide est constant (dilatation très faible).
2) L’état liquide
Un liquide n’a pas de forme propre. Il prend la forme du récipient qui le contient.
On ne peut pas le prendre avec les doigts.
La surface d’un liquide au repos (appelée surface libre) est plane et horizontale.
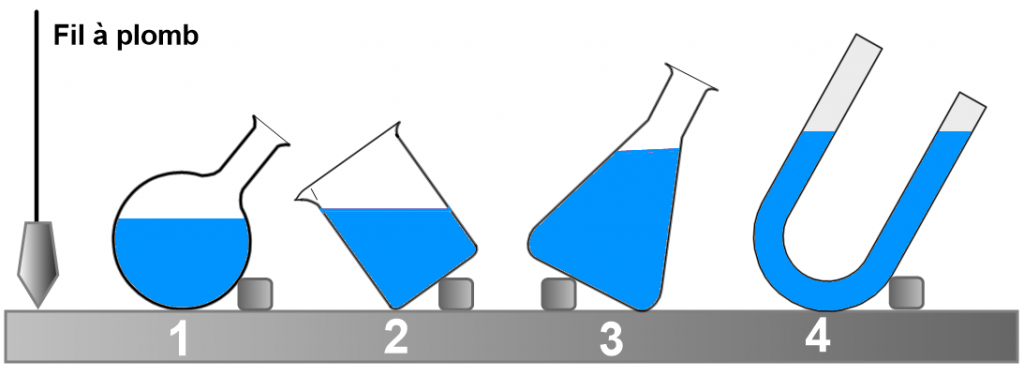 Le volume d’un liquide est constant (dilatation faible : thermomètre)
Le volume d’un liquide est constant (dilatation faible : thermomètre)
3) L’état gazeux
Un gaz n’a pas de forme propre, il occupe tout le volume qu’on lui offre : on dit qu’il est expansible.
Le volume d’un gaz est variable (il dépend du volume qui lui est offert).
IV – Description microscopique de la matière
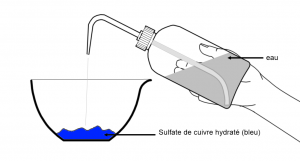
1) L’eau à l’échelle microscopique
A l’échelle microscopique, l’eau est constituée de très petites particules appelées molécules.
Suivant les états de la matière, ces molécules s’organisent différemment.
2) Description microscopique de l’état solide
Les molécules d’un solide sont très proches les unes des autres et immobiles.
Les molécules sont liées entre elles.
L’état solide est un état compact et ordonné.
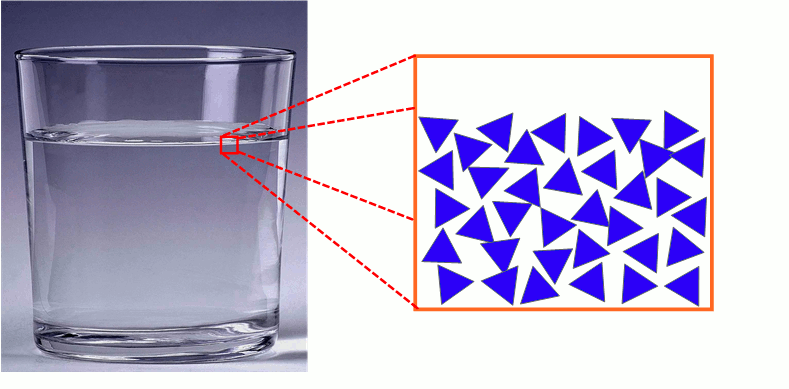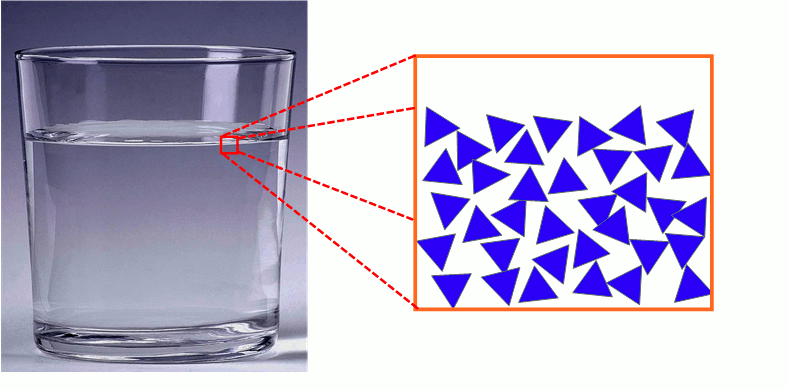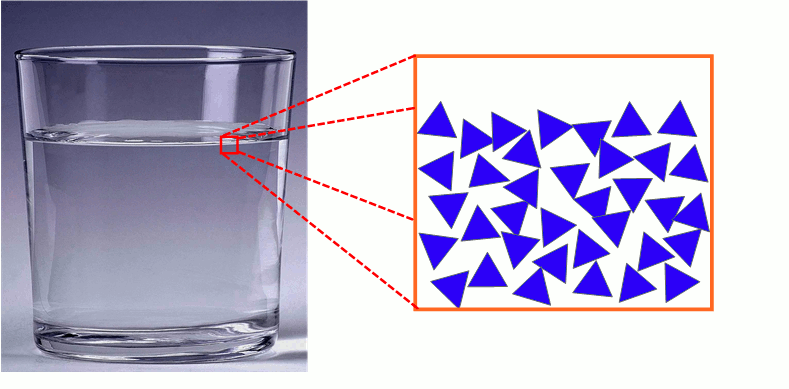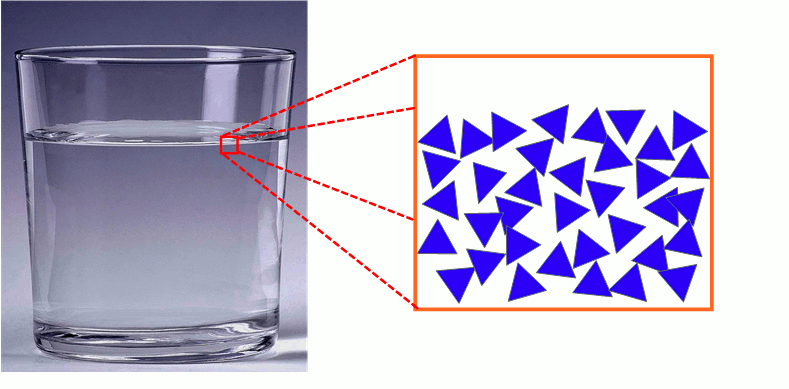
3) Description microscopique de l’état liquide
Les molécules d’un liquide sont proches les unes des autres et agitées. Elles sont faiblement liées et peuvent glisser les unes sur les autres (écoulement des liquides).
L’état liquide est compact et désordonné.
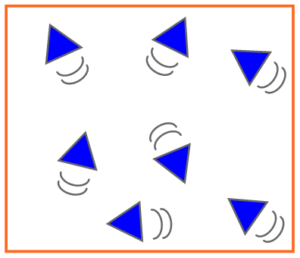
4) Description microscopique de l’état gazeux
Les molécules d’un gaz sont éloignées les unes des autreset très agitées. Elles se déplacent dans tous les sens à grande vitesse. Les molécules ne sont pas liées.
L’état gazeux est dispersé et très désordonné.