I – Les atomes.
1) Historique du modèle de l’atome.
Dès 420 avant J.C., Démocrite (philosophe grec) a l’intuition de l’existence des atomes et invente leur nom (« atomos » en grec qui signifie « que l’on ne peut couper »). Ceux-ci sont très petits, de différentes formes (rond ou crochus, lisses ou rugueux) et s’associent pour former les objets qui nous entourent.
Aristote (philosophe grec) qui pensait que la matière était constituée de 4 éléments (le feu, la terre, l’air et l’eau) conteste l’existence des atomes et son prestige est tel qu’il faut attendre le début du XIXème siècle pour que cette idée reprenne vie.
Les alchimistes du Moyen Age développent une chimie du « pifomètre ». Elle consiste plutôt en de multiples tentatives d’expériences plus ou moins au hasard en vue d’un but, par exemple transformer le plomb en or ! Ils développent de nouvelles technique (distillation, métallurgie) en se fondant sur la théorie d’Aristote.
En 1647, un français, Pierre GASSENDI, remet au goût du jour l’idée d’atomes et affirme que toutes les substances se composent de particules indivisibles, les atomes. Les atomes diffèrent par la forme , la grandeur et la masse. Selon lui, l’atome, c’est la même chose que le matériau de construction des maisons. Avec trois sortes de matériaux – briques, planches et poutres – on peut construire une foule de bâtisses des plus diverses. De la même façon, quelques dizaines d’atomes différents permettent à la nature de créer des milliers de corps absolument différents. Dans chacun des corps, ces atomes se réunissent en petits groupes que Gassendi appellera « molécules ».
A la fin du XVIIIe siècle, les expériences du chimiste français LAVOISIER montrent que l’air est un mélange de particules invisibles à l’œil nu, les molécules. La théorie des 4 éléments est morte et les savants de l’époque choisissent alors la théorie de Démocrite.
En 1805, John Dalton annonce au monde l’existence des atomes. Selon lui, la matière est composée de petites particules indivisibles appelées atomes, ces atomes s’assemblent selon des règles précises pour former des molécules et lors d’une transformation chimique, des molécules réagissent entre elles pour former de nouvelles molécules. Il faudra attendre les progrès technologiques de la fin du XXe siècle pour réussir à observer des atomes avec des microscopes très puissants.
2) Les atomes
Toute la matière (solide, liquide ou gazeuse) est formée d’atomes innombrables et microscopiques. Les objets et les êtres vivants sont composés d’atomes extrêmement petits et nombreux.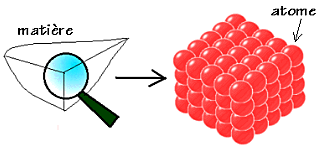
Imaginez un banc de sable vu de loin, on ne peut pas distinguer les grains qui le constitue. On peut les voir seulement en s’approchant de très près. La matière qui nous entoure est également constituée de petits grains de matière appelés atomes, ils ne peuvent être observés ni à l’œil nu, ni avec les microscopes optiques conventionnels.
L’image ci-contre a été obtenue avec un microscope à effet tunnel où l’on peut distinguer la position des atomes.
Un atome mesure environ 0.1 à 1 nanomètre ( 1 nm = 10-9 m = 1 milliardième de mètre).
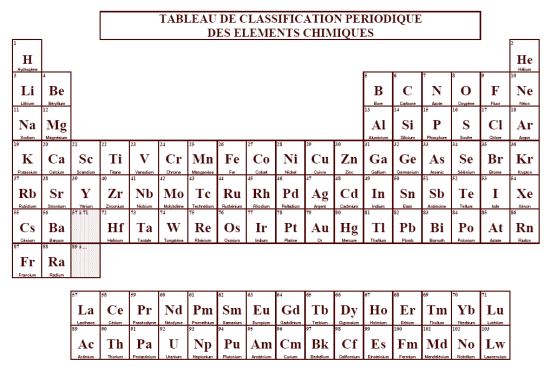
Il existe 92 types d’atomes naturels différents. On les retrouve dans le tableau de la classification périodique des éléments chimiques.
Comme il existe plus d’une centaine d’atomes différents, on attribue un symbole à chaque atome de même nature. Il commence toujours par une lettre majuscule suivie parfois d’une lettre minuscule. 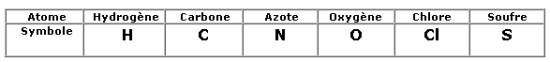
Pour mieux visualiser ces atomes invisibles à notre œil, on utilise souvent un modèle qui représente les atomes courants sous la forme de boules colorées, à chaque atome correspond une couleur. 
II – Les molécules
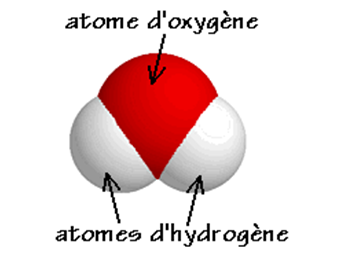
On l’a compris, la matière n’est finalement qu’un assemblage d’atomes mais la facon dont ils s’assemblent est très différente suivant le corps considéré. Dans un morceau de fer, on a un empilement d’atomes de fer identiques mais dans l’eau les atomes sont associés entre eux par « paquets » identiques d’atomes. Un « paquet » est appelé molécule, dans le cas de l’eau chaque « paquet » contient 1 atome d’oxygène et 2 atomes d’hydrogène.
Les atomes se groupent pour former des molécules. Une molécule est formée d’au moins deux atomes reliés ensemble par des liaisons chimiques.
On représente une molécule par une formule et un modèle moléculaire.
Ex : la molécule d’eau
- Formule :
La formule est formée par les symboles des atomes présents, le nombre de chaque atome présent est écrit en bas à droite du symbole (en indice). L’indice 1 ne s’écrit pas, on écrit juste le symbole de l’atome. 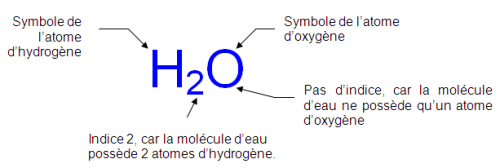
- Modèle moléculaire :
Il existe des molécules simplement constituées de deux atomes : ce sont les molécules diatomiques. 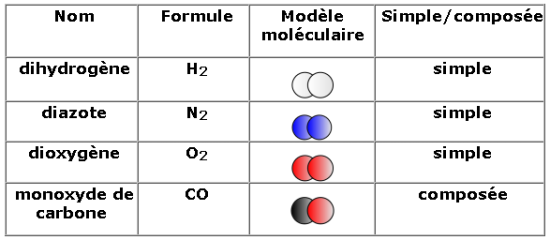
Il existe aussi des molécules constituées de trois atomes : ce sont les molécules triatomiques. 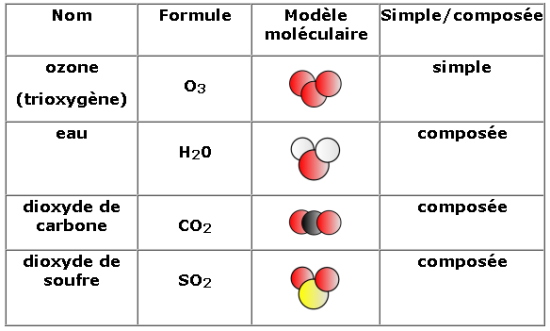 Il existe bien sûr des molécules plus complexes, qui peuvent contenir jusqu’à plusieurs millions d’atomes (ADN).
Il existe bien sûr des molécules plus complexes, qui peuvent contenir jusqu’à plusieurs millions d’atomes (ADN).
III – Interprétation de la combustion du carbone.
Lors de la combustion du carbone dans le dioxygène, il se forme du dioxyde de carbone.
Réactifs : carbone + dioxygène
Produits : dioxyde de carbone
Bilan : carbone + dioxygène → dioxyde de carbone
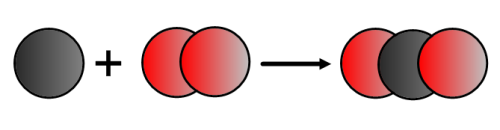
Equation-bilan : C + O2 → CO2
- Lors d’un réaction chimique, les atomes se réarrangent, mais ne disparaissent pas.
- L’équation-bilan doit être équilibrée (ou ajustée) : les mêmes atomes figurent, en même nombre , dans les réactifs et dans les produits.
Dans ce cas, l’équation-bilan est équilibrée.
Cas de la combustion incomplète du carbone:
Si la combustion du carbone est incomplète, alors il y a formation de monoxyde de carbone :
Réactifs : carbone + dioxygène
Produits : monoxyde de carbone
Bilan : carbone + dioxygène → monoxyde de carbone
Equation-bilan : C + O2 → CO
Cette équation-bilan n’est pas équilibrée…
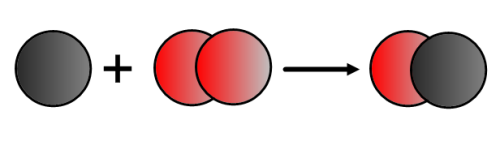
Équilibrer une équation-bilan signifie que l’on va placer devant les formules des réactifs et des produits des coefficients entiers, les plus petits possibles, afin de retrouver le même nombre d’atomes de chaque nature dans la partie gauche de l’équation (dans les réactifs) et dans la partie droite (dans les produits). On n’a évidemment pas le droit de modifier la formule chimique des réactifs et des produits !
Exemple : La formule chimique du dioxygène est O2 et l’on n’a pas le droit d’écrire O !!! Pour équilibrer l’équation-bilan de la réaction chimique précédente, il faut donc écrire:
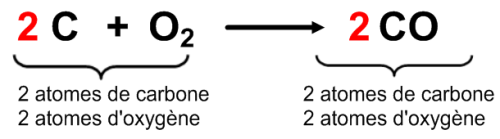
Equation-bilan : 2 C + O2 → 2 CO
Traduisons cette équation-bilan à l’aide des modèles : 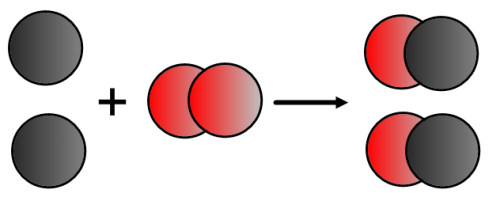
On voit bien qu’il y a autant d’atomes de carbone et d’oxygène dans les réactifs et dans les produits. L’équation-bilan équilibrée (ou ajustée) s’écrit bien :
IV – Conservation de la masse lors d’une transformation chimique.
LAVOISIER, en 1777, affirma « Rien ne se perd, rien ne se crée, tout se transforme ».
Expérience :
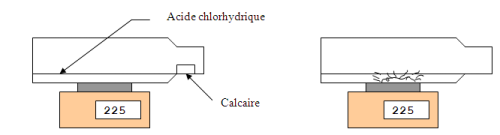
On fait réagir un morceau de calcaire avec de l’acide chlorhydrique dans une bouteille fermée après l’avoir pesée. Après la réaction, on pèse à nouveau la bouteille. Nous constatons que la masse ne varie pas au cours de la réaction chimique entre l’acide et le calcaire.
Conclusion : Au cours d’une réaction chimique, la masse des réactifs disparus est égale à la masse des produits formés.
V – Mélange, transformation chimique ou transformation physique
Mélange :
Lors d’un mélange, des substances sont réunies sans qu’aucune ne disparaisse ou n’apparaisse. Les substances d’un mélange peuvent être récupérées grâce à des différentes méthodes de séparation (décantation, filtration, distillation, chromatographie,…).
Il existe les mélanges homogènes qui sont constitués de plusieurs constituants que l’on ne peut pas distingur à l’oeil nu (eau salée, sirops, thé, …) et les mélanges hétérogènes qui sont des mélanges dont on peut distinguer au moins deux constituants à l’oeil nu (boissons gazeuses, eau+huile, eau boueuse, …).
Transformation chimique :
Lors d’un transformation chimique, certaines substances disparaissent (on les appelle les réactifs) et d’autres apparaissent (on les appelle les produits).
Exemple de transformations chimiques : Les combustions , réaction entre l’acide chlorhydrique et le calcaire, transformation du sucre en caramel,….
Transformation physique :
Lors d’une transformation physique (changement d’état, déformations,…), les substances ne font que changer de forme ou d’état physique.
Exemples de transformations physiques : la glace qui fond, l’eau qui s’évapore, le beurre qui fond,…
Quiz sur les atomes et la réaction chimique
Quiz sur les équations-bilan :







Merci beaucoup