I – Étude de la solidification
Expérience:
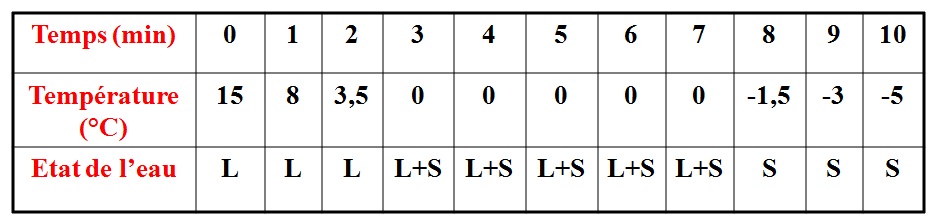
On place un tube à essais, contenant de l’eau distillée, dans un mélange réfrigérant.
On observe le contenu du tube, et on relève la température toutes les minutes.
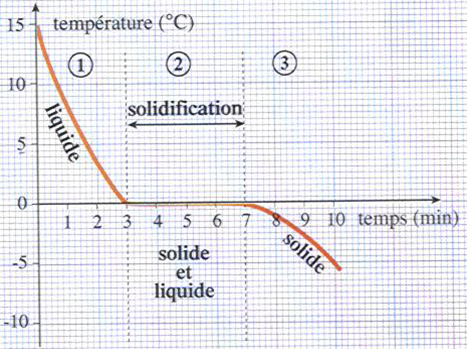
On trace alors le graphique de la température de l’eau en fonction du temps écoulé:L : LIQUIDE
L+S : LIQUIDE +SOLIDE
S: SOLIDE
 Conclusion:
Conclusion:
Durant la solidification de l’eau PURE, la température reste constante, égale à : 0°C, c’est la température de solidification de l’eau pure.
Le changement d’état d’un corps pur s’effectue à température constante.
Cette température nous permet d’identifier le corps pur.
II – solidification d’un mélange
Préparons de l’eau salée, puis refroidissons ce mélange.
On relève alors toutes les minutes la température et on trace le graphe donnant l’évolution de la température en fonction du temps.
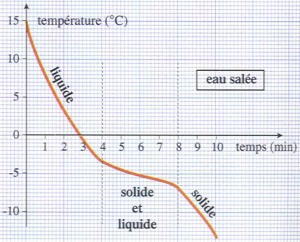 Durant la solidification du mélange, la température ne reste pas constante : il n’est pas possible de définir une température de solidification d’un mélange.
Durant la solidification du mélange, la température ne reste pas constante : il n’est pas possible de définir une température de solidification d’un mélange.
III – Étude de la fusion de l’eau.
Expérience:
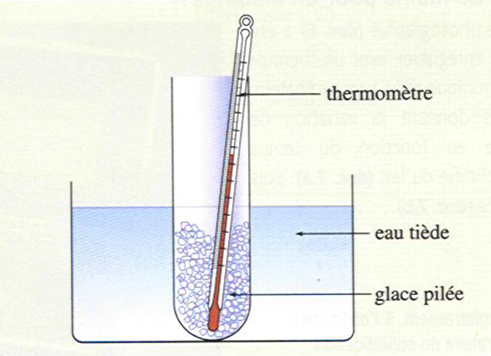
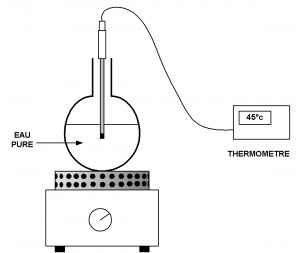
Plaçons un tube à essais contenant de la glace pilée dans de l’eau tiède.
Relevons alors la température dans le tube toutes les 30 secondes en procédant comme dans l’expérience précédente.
 Questions:
Questions:
trace un graphique représentant la variation de température en fonction du temps.
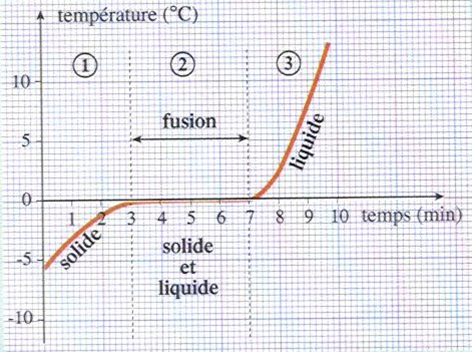 Durant la fusion de la glace, la température reste constante égale à 0°C, ( température de fusion de l’eau).
Durant la fusion de la glace, la température reste constante égale à 0°C, ( température de fusion de l’eau).
Conclusion:
La fusion et la solidification de l’eau pure se produisent à la même température : 0°C
IV – Étude de l’ébullition.
Si on chauffe un liquide, on observe, qu’à partir d’une certaine température de grosses bulles de vapeur prennent naissance dans le liquide et s’échappent à la surface. L’ébullition est donc le passage de l’état liquide à l’état gazeux.
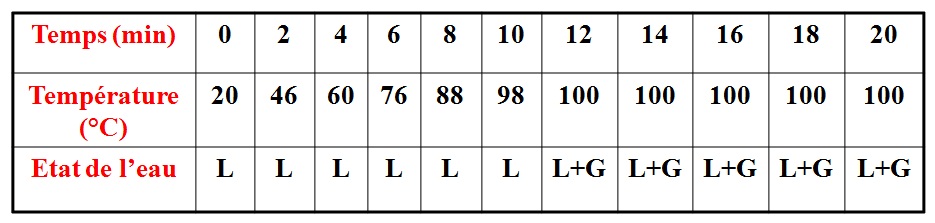
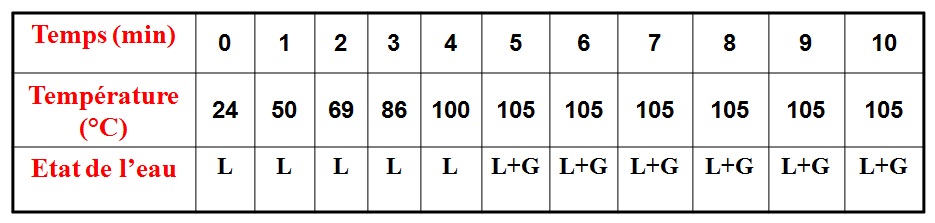
Expérience:
L : LIQUIDE
L+G : LIQUIDE + GAZ
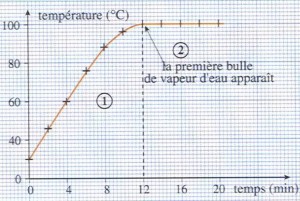
Observations:
lorsque l’on chauffe l’eau pure:
– la température de l’eau liquide s’élève;
– la température reste constante égale à 100°C, tandis que l’eau bout et se transforme en gaz.
Conclusion:
– La température reste constante au cours de l’ébullition d’un corps pur.
– 100°C est la température d’ébullition de l’eau pure.
V – Influence de la pression.
Expérience:
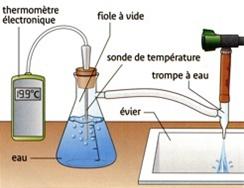 Observations:
Observations:
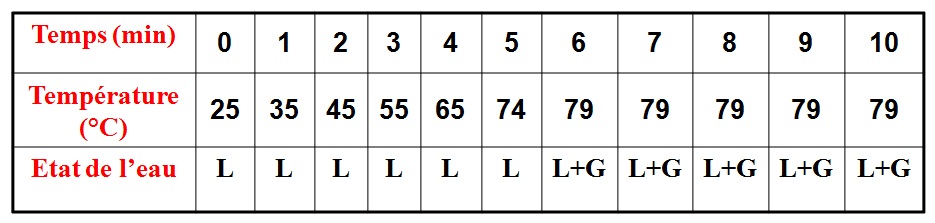
Si la pression diminue, l’eau bout à une température inférieure à 100°C.
Conclusion:
La température d’ébullition de l’eau dépend de la pression .
L’eau pure ne bout à 100°C que sous la pression atmosphérique normale (1013 hPa).
En haute montagne, à 4000 m d’altitude par exemple, la pression est plus faible; la température d’ébullition de l’eau n’est que de 85°C : la cuisson des aliments est donc plus lente!
En revanche, dans un autocuiseur fermé et chauffé, la pression est élevée; l’eau bout à une température supérieure à 100°C. Cela permet de cuire rapidement les aliments!
Exemples de températures d’ébullition de corps purs sous la pression atmosphérique normale :
- Alcool : 79°C
- Mercure : 357°C
- Fer : 2750°C
Conclusion:
Sous une pression donnée, les températures de changement d’état d’un corps pur caractérisent ce corps et permettent de l’identifier.
Exercices changement d'état


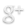




merci infiniment
Bonjour comment vs renvoyez le travail pas d ordi sipmlement portable 0635660662
Merci beaucoup ++++ pour cette vidéo
1) Marc met une bouteille d’eau dans le congélateur. Après une heure, il commence à prendre sa température chaque 15 min. Temps 1h 1h 15min 1h 30 min Température 5 c ➤ Comment varie la température durant ► Sous quel (s) état (s) se trouve l’eau : – Apres 1h 15 min:……. – Apres 1h 45 min :……. – Apres 2h 15 min: ➤ Durant cette expérience l’eau passe de l’état. . Ce changement d’état s’appelle la 3^ prime c; O^ * c 1h 45 min O^ prime c 2h 2h 15min -4°c cette expérience ? à l’état
BONJOUR
J’ai mieux compris avec ça qu’en cours
Merci beaucoup sa m’aide vraiment pour mon travail en groupe