I – Qu’est-ce qu’une combustion ?
L’expérience dans laquelle une substance brûle est appelée combustion.
• Le corps qui brûle est le combustible.
• Le corps qui permet la combustion est le comburant.
Au cours d’une combustion,
• les substances qui disparaissent sont les réactifs,
• les substances qui se forment sont les produits.
Une combustion est une réaction chimique. On peut écrire le bilan de la réaction de combustion :
Réactifs → Produits
Combustible + Comburant → Produits de la réaction
« + » signifie « réagit avec » ; « -> » signifie « donne »
II – La combustion du carbone.
Lorsque du carbone brûle dans le dioxygène, la combustion est très vive : il se forme du dioxyde de carbone tandis que du carbone et du dioxygène disparaissent.
• Le carbone est le combustible.
• Le dioxygène est le comburant.
• Le dioxyde de carbone est un produit de la réaction.
On peut donc écrire le bilan suivant :
Remarques :
• Une combustion nécessite une source de chaleur (flamme, étincelle) pour pouvoir démarrer.
• Test du dioxyde de carbone :
Le dioxyde de carbone trouble l’eau de chaux.
• Test du dioxygène :
La flamme d’une bûchette incandescente est ranimée en présence de dioxygène pur.
III – La combustion du butane
Un briquet contient du butane. Lorsqu’on crée une étincelle à l’aide du briquet, le butane gazeux qui s’échappe s’enflamme en réagissant avec le dioxygène de l’air.
Lors de la combustion complète du butane : le combustible (butane) et le comburant (dioxygène) sont consommés.
Il se forme des produits nouveaux :
– de la vapeur d’eau (buée),
– du dioxyde de carbone (eau de chaux troublée).
Le bilan de cette combustion est :
Butane + dioxygène → Dioxyde de carbone + eau
IV – Les combustions incomplètes.
S’il n’y a pas suffisamment de dioxygène lors de la combustion du butane, la flamme devient jaune et éclairante.
• On dit que la combustion est incomplète : Il se forme du carbone et aussi un gaz, incolore et inodore, le monoxyde de carbone (gaz toxique, voire mortel).
• Lorsque la flamme est bleue, cela signifie que la combustion est complète, et il ne se forme que du dioxyde de carbone et de l’eau.
Une combustion incomplète peut produire du carbone et du monoxyde de carbone.
IV – Les dangers des combustions.
Les combustions présentent différents risques :
• Risque d’incendie : si la combustion se propage à d’autres objets ; il faut donc éloigner des flammes toute matière combustible.
• Risque d’asphyxie : si le dioxygène de l’air est consommé par la combustion ; il faut donc éviter de boucher les ventilations.
• Risque d’intoxication par le monoxyde de carbone : si la combustion est incomplète ; il faut donc bien faire régler les appareils de chauffage et ventiler les locaux.
• Risque d’explosions : si les combustibles gazeux sont mélangés à l’air dans certaines proportions ; il faut donc éviter les fuites, ventiler les locaux, enflammer rapidement le combustible quand on ouvre l’arrivée de gaz et munir les appareils de dispositifs de sécurité.
Quiz sur les combustions
Résumé-Quiz
0 questions correctes sur 11
Questions:
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
Information
Je sais que
- La combustion du carbone nécessite du dioxygène
- La combustion du carbone produit de dioxyde de carbone.
- La combustion du méthane et/ou du butane dans l’air nécessite du dioxygène
- La combustion du méthane et/ou du butane produit de dioxyde de carbone et de l’eau.
- L’identification du dioxyde de carbone se fait à l’aide du test à l’eau de chaux et qu’il se forme un précipité blanc.
- Pour réaliser une combustion, il faut des réactifs : combustible et comburant
- Les réactifs sont consommés au cours de la combustion et des nouveaux produits se forment.
- Les combustions libèrent de l’énergie.
- Certaines combustions peuvent être dangereuses (incomplètes, explosives)
Je suis capable de :
- Réaliser, décrire et schématiser la combustion du carbone dans le dioxygène.
- Réaliser le test du dioxyde de carbone.
- Respecter les règles de sécurité lors de toute combustion
- Réaliser, décrire et schématiser la combustion du méthane ou du butane dans l’air.
Vous avez déjà rempli le questionnaire avant. Par conséquent, vous ne pouvez pas recommencer.
Quiz is loading...
You must sign in or sign up to start the quiz.
Vous devez finir le quiz suivant, avant de commencer celui-ci :
Résultats
0 questions sur 11 répondues correctement
Votre temps:
Temps écoulé
Vous avez atteint 0 points sur 0 , (0)
| Score moyen |
|
| Votre score |
|
Categories
- Not categorized 0%
| Position | Nom | Passé le | Points | Résultat |
|---|---|---|---|---|
| Chargement du tableau | ||||
| Aucune donnée disponible | ||||
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- Répondu
- Examiner
-
Question 1 sur 11
1. Question
1 pointsLors d’une combustion, le corps qui brûle est appelé :
Exact
Inexact
-
Question 2 sur 11
2. Question
1 pointsLors d’une combustion, le corps qui permet la combustion est appelé :
Exact
Inexact
-
Question 3 sur 11
3. Question
1 pointsLors d’une réaction chimique, les substances qui s’associent et disparaissent sont :
Exact
Inexact
-
Question 4 sur 11
4. Question
1 pointsLors d’une réaction chimique, les substances qui se forment sont :
Exact
Inexact
-
Question 5 sur 11
5. Question
6 pointsComplète le texte suivant (attention à l’orthographe!):
- a. La combustion du carbone est une réaction chimique . Le carbone et le dioxygène sont les (réactifs, réactif, reactif, réactifs). Le dioxyde de carbone est le (produit) . b. La combustion du carbone dans le dioxygène produit du (dioxyde, dioxide) de carbone. Le dioxyde de carbone (trouble) l'eau de chaux. c. Si la combustion du carbone est (incomplète, incomplete), il se dégage du (monoxyde, monoxide) de carbone qui est toxique.
Exact 6 / 6PointsInexact / 6 PointsIndice
produit – dioxyde – monoxyde – réactifs – trouble – incomplète
-
Question 6 sur 11
6. Question
4 pointsLors de la respiration, nous inspirons du dioxygène et expirons du dioxyde de carbone.
Pendant la journée, les plantes prélèvent plus de dioxyde de carbone dans l’atmosphère qu’elles n’en rejettent. Grâce à la chlorophylle, ce dioxyde de carbone et l’eau se combinent pour former du glucose et du dioxygène : c’est la photosynthèse.Quels sont les réactifs de la réaction de photosynthèse ?
Exact
Inexact
-
Question 7 sur 11
7. Question
4 pointsLors de la respiration, nous inspirons du dioxygène et expirons du dioxyde de carbone.
Pendant la journée, les plantes prélèvent plus de dioxyde de carbone dans l’atmosphère qu’elles n’en rejettent. Grâce à la chlorophylle, ce dioxyde de carbone et l’eau se combinent pour former du glucose et du dioxygène : c’est la photosynthèse.Quels sont les produits de la réaction de photosynthèse ?
Exact
Inexact
-
Question 8 sur 11
8. Question
1 pointsLors de la respiration, nous inspirons du dioxygène et expirons du dioxyde de carbone.
Pendant la journée, les plantes prélèvent plus de dioxyde de carbone dans l’atmosphère qu’elles n’en rejettent. Grâce à la chlorophylle, ce dioxyde de carbone et l’eau se combinent pour former du glucose et du dioxygène : c’est la photosynthèse.Quel est le bilan de la réaction de photosynthèse ?
Exact
Inexact
-
Question 9 sur 11
9. Question
4 pointsPour brûler entièrement 1 g de carbone, il faut utiliser 10 L d’air.
On réalise alors la combustion de 5 g de carbone dans 50 L d’air.
Quelles substances retrouve-t-on à la fin de cette réaction?
Exact
Inexact
On sait que pour brûler 1 g de carbone entièrement, il faut 10 L d’air. Donc, pour brûler 5g de carbone, il faudra 50 L d’air. Tout le carbone disparaît alors et il se forme du dioxyde de carbone.
Le dioxygène est entièrement consommé et disparaît, mais comme l’air contient du diazote (et qu’il ne réagit pas avec le carbone), il reste aussi du diazote!
-
Question 10 sur 11
10. Question
4 pointsPour brûler entièrement 1 g de carbone, il faut utiliser 10 L d’air.
On réalise alors la combustion de 3 g de carbone dans 50 L d’air.
Quelles substances retrouve-t-on à la fin de cette réaction?
Exact
Inexact
On sait que pour brûler 1 g de carbone, il faut 10 L d’air, donc pour brûler 3 g de carbone il faut 30 L d’air.
Il y a donc 20 L d’air non utilisé, et cela signifie qu’il reste du dioxygène et du diazote à la fin de la réaction.
De plus, le carbone qui a disparu a formé du dioxyde de carbone.
-
Question 11 sur 11
11. Question
4 pointsPour brûler entièrement 1 g de carbone, il faut utiliser 10 L d’air.
On réalise alors la combustion de 5 g de carbone dans 20 L d’air.
Quelles substances retrouve-t-on à la fin de cette réaction?
Exact
Inexact
Avec 20 L d’air, on ne peut brûler que 2 g de carbone : il restera donc 3 g de carbone non brûlé à la fin de la réaction.
Comme, il y avait trop d’air pour cette combustion, il restera aussi du dioxygène et du diazote !

Chapitre IV – Les combustions(ppt)
Chapitre IV – Les combustions (doc)

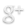





Merci beaucoup pour ce cour très bien expliqué.
je trouve que c'est le meilleur site college que j'ai pu recontrer merci
super site merci bcp!!!!!!!
oui c’est vrai
Merci beaucoup c’est vraiment intéressant
oui j’ai appris mon cour par coeur pour mon éval et j’ai u 20/20
Salam walikoum tout le monde, ouais merci la famille pour la ptite explication du cours de chimie, mais bon perso je me prend pas la tête, je fais les anti sèches mdrrr miskin vous apprenez ça! combustion, o2 chai pas quoi moi tout ce que je sais c que le couscous, c'est trop bon ! allez bye bye la famille, tenez vous bien et sutout passez le bonjour à mahmoud !!! 😉
Pareil couscous
wa3alykoum salam ce site est vraiment intéressant
Wa3alykom salam ouais ce site est intéressant
Merci vraiment pour vos publications vous m’avez permis de comprendre beaucoup de choses û
Dites moi qu’est ce que je peux prendre comme exemple comme produits de la combustion dans l’air?
merci pour cette explication, j’espère que tu vas bien.mes amie je vous laissé un conseil,ce cite parmi les plus beaux cites collège,car il est court et bien expliqué et qu’il résume tous le cour.je vous remerci pour ce cour,et au revoir.
merci beaucoup sa ma vraiment aider
Merci beaucoup pour cette eclaississement
j’adore trop ce site
Merci pour les documents bien détaillés.
bien dit rafik rafik!!!!
c bien
L9lawi
Zb u l9lawi
Merci car mon prof a copier coller de ce site et demain on aura un qcm et toutes la classe imagine qu’on aura le meme
on trouve ou les corrections des evals??
Bonjour , vous pouvez m’aider à cette question niveau 4ème .Cette combustion est une transformation chimique : on applique donc la règle de ___________________________________ : il y a toujours le même nombre d’atomes de part et d’autre avant et après la réaction.
Au niveau 4ème, on parle de la règle de « la conservation de la masse » au cours d’une transformation chimique.
ça veut dire que la masse totale des réactifs est égale à la masse totale des produits c’est l’avoisier le père de la chimie qui l’a dit
Lavoisier, pas l’avoisier
Mrc bcp.(français)
Thank you alot (anglais)
Gracias mucho(Espanol)
Chokran(morrocain)
Mrc beaucoup pour vousj’ai bien compris est
tres dangereux
Bien
mdr assume que tu connais mon nom
Très interessant . Cimer
Merci pour votre leçon
J’ai bien aimé
sing sang sung merci!
Trop bien le site mais trop de pub
Top le petit gif de la formation du dioxyde de carbone 🙂
Pour ceux qui veulent aller un peu plus loin :
https://mathssciences.enormisez.com/bac-professionnel/t-p-combustion-hydrocarbures-thermique-premiere-bac-pro/
Merci beaucoup car cet cité nous permet de mieux comprendre la chimie Merci beaucoup
Bonsoir je besoin d’aide au niveau des exercices svp.
Merci