I – Les solides dissous dans les boissons.
Expérience : 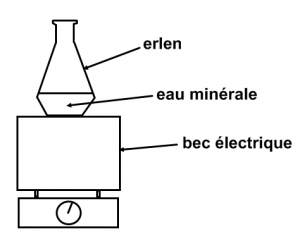
Chauffons un peu d’eau minérale dans un erlenmeyer.
Observations :
L’eau s’est entièrement vaporisée et on observe l’apparition d’une poudre blanche sur les parois de l’erlenmeyer.
Interprétation :
L’étiquette de l’eau minérale indique l’existence de particules appelées ions : sodium, calcium, magnésium, bicarbonates, sulfates, chlorures….

Ces ions proviennent de sels minéraux dissous dans l’eau. Ce sont ces sels que nous avons observé sur les parois du tube à essais.
Conclusion :
L’eau du robinet et l’eau minérale ne sont pas des eaux pures car elles contiennent des sels minéraux dissous.
II – La distillation
Expérience :
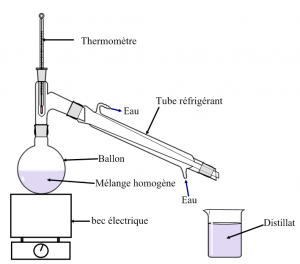 On place un mélange homogène (eau salée) dans le ballon de ce dispositif et on chauffe le mélange.
On place un mélange homogène (eau salée) dans le ballon de ce dispositif et on chauffe le mélange.
Observations :
Le mélange se met à bouillir et de la vapeur (d’eau) s’élève et passe dans le tube réfrigérant.
Cette vapeur se refroidit brutalement au contact des parois froides du réfrigérant à eau et elle se liquéfie.
Des gouttes d’eau pure se forment et tombent dans le bécher.
Le distillat (résultat de la distillation) ne contient plus de sel car le sel ne s’est pas évaporé.
Bilan de la distillation:
Il reste dans le ballon tous les composés solides initialement dissous dans l’eau.
Le distillat aussi appelé eau distillée est formée d’eau quasiment pure.
Conclusion :
La distillation permet de séparer les constituants d’un mélange homogène.
Remarque: il existe des techniques de distillations plus complexes qui permettent des séparer des mélanges homogènes de liquide (obtention d’eau de vie à partir du vin,…).
III – La chromatographie
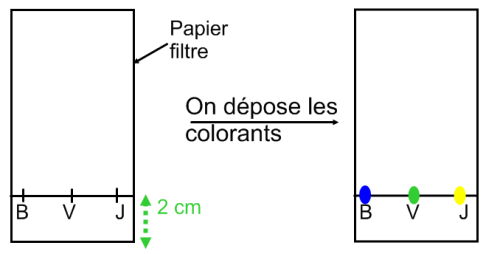
Expérience : On réalise l’expérience suivante.
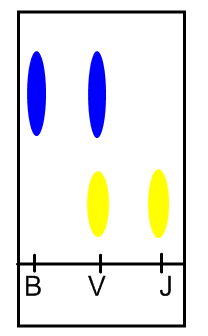
On prépare une plaque de chromatographie en découpant un rectangle de papier filtre puis en dessinant au crayon à papier un trait à 2cm du bord inférieur. On dépose ensuite 3 colorants Bleu (B), Vert (V) et Jaune (J) sur ce trait.
Ces colorants peuvent être issus de feutres lavables à l’eau de la même marque ou de colorants alimentaires.
 On place la plaque de chromatographie dans un verre contenant un peu d’eau salée (éluant).
On place la plaque de chromatographie dans un verre contenant un peu d’eau salée (éluant).
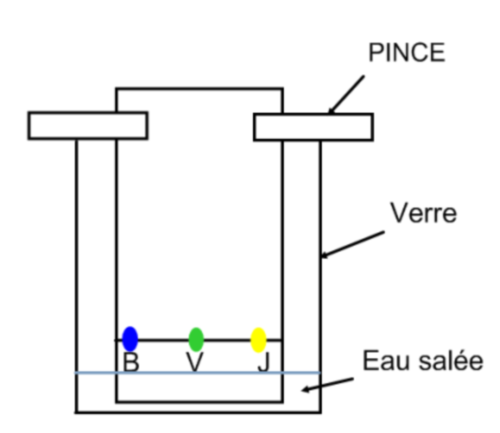 Pour que la chromatographie puisse commencer, la plaque doit être suspendue au dessus de la cuve et tremper dans l’eau mais sans que la ligne de dépôt et les tâches de colorant ne soient en contact avec cette dernière.
Pour que la chromatographie puisse commencer, la plaque doit être suspendue au dessus de la cuve et tremper dans l’eau mais sans que la ligne de dépôt et les tâches de colorant ne soient en contact avec cette dernière.
Observations :
- L’eau imbibe le papier filtre du bas vers le haut en entraînant les colorants.
- On observe le chromatogramme suivant :
Grâce au phénomène de capillarité l’eau est aspirée par le papier filtre et s’élève (comme le café qui s’élève dans un sucre).
On observe que les colorants ne se déplacent pas à la même vitesse : chaque colorant possède sa vitesse de migration.
La tâche verte s’est séparée en deux couleurs : jaune et bleu : cela signifie que le colorant vert n’est pas pur , c’est un mélange de deux colorants(bleu et jaune).
Le colorant bleu ne donne qu’une tâche : cela signifie que ce colorant est pur.
Le colorant jaune est pur aussi car il ne forme qu’une seule tâche.
Remarque : Lorsque 2 tâches sont à la même hauteur, cela signifie qu’elles correspondent au même colorant.
Conclusion:
La chromatographie est utilisée pour séparer les différentes substances colorées présentes dans un mélange homogène.
On l’utilise en général dans un but d’analyse: afin de déterminer la composition d’un mélange de substances colorées.
Chromatographie de bonbons


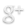




MERCI
Bonjour
un grand merci pour le cours et le QCM sur la chromatographie.
J’aurai aimé avoir un QCM pour chaque technique de séparation des constituants d’un mélange.
un grand merci
j’adore ce site merci beaucoup.
le quizz étais facil